Différence entre le carbone 12 et le carbone 14
Le différence clé entre le carbone 12 et le carbone 14 est que Le carbone 12 a 6 neutrons dans son noyau atomique tandis que le carbone 14 a 8 neutrons.
Le carbone 12 et le carbone 14 sont des isotopes de l'atome de carbone. L'atome de carbone a toujours 6 protons. Il a généralement 6 neutrons également, c'est pourquoi nous l'appelons Carbon 12. Mais parfois, il y a 8 neutrons au lieu de 6, c'est-à-dire quand il devient carbone 14. Dans les réactions chimiques, le carbone 12 et le carbone 14 se comportent de manière similaire. Généralement, le carbone se trouve dans l'état C 12, mais parfois il est également disponible comme C 14.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le carbone 12
3. Qu'est-ce que le carbone 14
4. Comparaison côte à côte - carbone 12 vs carbone 14 sous forme tabulaire
5. Résumé
Qu'est-ce que le carbone 12?
Le carbone 12 est l'isotope de carbone naturel le plus commun, de masse 12. C'est la base de l'échelle acceptée des unités de masse atomique. L'abondance de ce carbone est d'environ 99%.

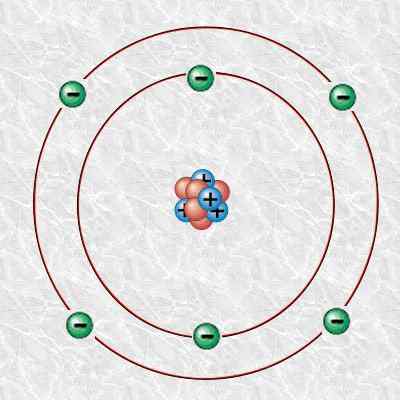
Figure 1: Atome de carbone
De plus, cet atome de carbone se compose de 6 protons, 6 électrons et 6 neutrons. Nous pouvons désigner le carbone 12 scientifiquement comme 12C. Sa masse isotopique est de 12 u.
Qu'est-ce que le carbone 14?
Le carbone 14 est un isotope de carbone commun. Nous l'appelons «radiocarbone» car il s'agit d'un isotope de carbone radioactif. Le noyau atomique de cet atome contient 6 protons, 6 électrons et 8 neutrons. Sa masse isotopique est de 14 u. De plus, le carbone 14 est très rare et son abondance est d'environ 1 partie par milliard.
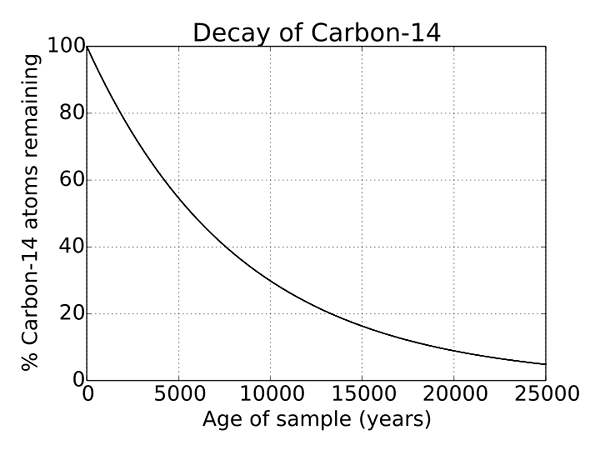
Figure 2: Décomposition radioactive du carbone 14
Puisque C 14 est un isotope instable de l'atome de carbone, il subit une décroissance radioactive. Et c'est un processus qui se produit pour chaque isotope instable et est un processus naturel. Il s'agit d'une propriété unique de C 14 et est utilisée pour la détermination des objets qui ont des milliers d'années et sont largement utilisés en archéologie. La demi-vie de C 14 est de 5730 ans.
Quelle est la différence entre le carbone 12 et le carbone 14?
C 12 et C 14 sont des isotopes de l'atome de carbone. La principale différence entre le carbone 12 et le carbone 14 est que le carbone 12 a 6 neutrons dans son noyau atomique tandis que le carbone 14 a 8 neutrons. Puisque le poids des protons et des neutrons est le même, ayant 8 neutrons, C 14 est 20% plus lourd que C 12. De plus, comme les deux C 12 et C 14 ont le même nombre de protons, leur nombre atomique est le même, mais leurs poids atomiques sont différents en raison du nombre différent de neutrons. C'est donc une différence significative entre C 12 et C 14.
De plus, C 12 et C 14 se comportent également différemment en ce qui concerne les réactions nucléaires. De plus, une autre différence entre C 12 et C 14 est que C 12 se trouve abondamment dans la croûte terrestre tandis que C 14 est rare. En outre, C 12 est un isotope stable de carbone tandis que C 14 est un isotope instable de l'atome de carbone et subit une décroissance radioactive.

Résumé - Carbone 12 vs carbone 14
Le carbone 12 et le carbone 14 sont des isotopes de l'atome de carbone. L'atome de carbone a toujours 6 protons, mais le nombre de neutrons peut varier. Par exemple, le carbone 12 et le carbone 14 sont des isotopes de carbone différents ayant un nombre différent de neutrons. Par conséquent, la principale différence entre le carbone 12 et le carbone 14 est que le carbone 12 a 6 neutrons dans son noyau atomique tandis que le carbone 14 a 8 neutrons.
Référence:
1. "Carbone.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 février. 2019, disponible ici.
Image gracieuseté:
1. «Carbon-atom» par Alejandro Porto - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Décriture radioactive du carbone-14 SVG» par Exeterpaul - propre travail (CC BY-SA 3.0) via Commons Wikimedia


