Différence entre le brome et le chlore

Le différence clé entre le brome et le chlore est que Le brome est moins réactif que le chlore.
Les halogènes sont des éléments du groupe VII dans le tableau périodique. Tous ces éléments sont des éléments électronégatifs et ont la capacité de produire -1 anion. Les membres de ce groupe comprennent le fluor, le chlore, le brome, l'iode et l'astatine.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le brome
3. Qu'est-ce que le chlore
4. Comparaison côte à côte - Bromine vs chlore sous forme tabulaire
5. Résumé
Qu'est-ce que le brome?
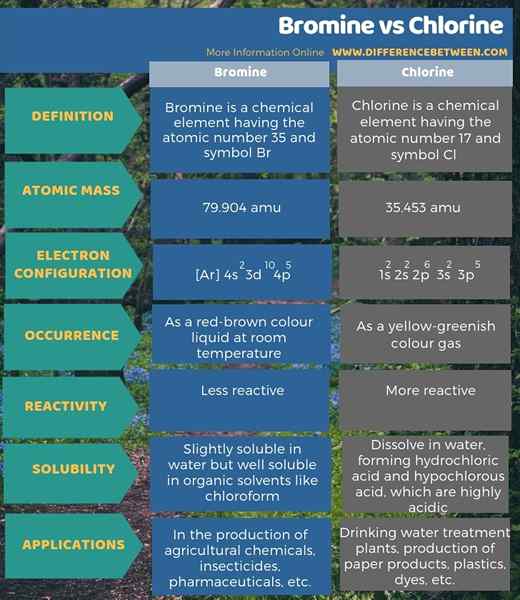
Le brome est indiqué par le symbole Br. C'est dans le 4e période du tableau périodique entre le chlore et les halogènes d'iode. Sa configuration électronique est [ar] 4s2 3Ddix 4p5. De plus, le nombre atomique de brome est de 35. Sa masse atomique est de 79.904. Le brome reste un liquide de couleur brun rouge à température ambiante. Il existe comme molécule diatomique, Br2. De plus, il est toxique, corrosif et a une forte odeur.
La réactivité chimique du brome se situe entre celle du chlore et de l'iode. Le brome est moins réactif que le chlore mais plus réactif que l'iode. Il produit l'ion bromure en prenant un électron. Par conséquent, il participe facilement à la formation de composés ioniques. En fait, dans la nature, le brome existe sous forme de sels de bromure au lieu de BR2. Il y a deux isotopes de brome stable. 79BR (50.69%) et 81BR (49.31%) sont ces isotopes.

Figure 01: Un échantillon de brome
Le brome est légèrement soluble dans l'eau mais bien soluble dans les solvants organiques comme le chloroforme. Il peut être produit en traitant des saumures riches en bromure avec du chlore gaz. De plus, il est largement important dans les laboratoires de l'industrie et des produits chimiques. Les composés de bromure sont utiles comme additifs à essence et pour les pesticides.
Qu'est-ce que le chlore?
Le chlore est un élément du tableau périodique que nous désignons par Cl. C'est un halogène (17e groupe) dans le 3rd période du tableau périodique. Le nombre atomique de chlore est de 17; Ainsi, il compte dix-sept protons et dix-sept électrons. Sa configuration d'électrons est 1s2 2s2 2p6 3s2 3p5. Depuis le p Le sous-niveau doit avoir 6 électrons pour obtenir la configuration d'électrons à gaz argon noble, le chlore a la capacité d'attirer un électron.

Figure 02: Un échantillon de chlore
Le chlore a une électronégativité très élevée, qui est d'environ 3 ans, selon l'échelle Pauling. De plus, le poids atomique du chlore est 35.453 AMU. À température ambiante, il existe sous forme de molécule diatomique (CL2). CL2 est un gaz de couleur jaune-greenish.
Le chlore a un point de fusion de -101.5 ° C et un point d'ébullition de -34.04 ° C. Parmi tous les isotopes de chlore, CL-35 et CL-37 sont les isotopes les plus stables. Lorsque le chlore gazeux se dissout dans l'eau, il forme de l'acide chlorhydrique et de l'acide hypochloreux, qui sont très acides.
Le chlore a tous les nombres d'oxydation variant de -1 à +7. De plus, c'est un gaz hautement réactif. Il peut libérer le brome et l'iode à partir de sels de bromure et d'iodure, respectivement. Par conséquent, il a la capacité d'oxyder les anions d'éléments situés en dessous du chlore dans le tableau périodique. Cependant, il ne peut pas oxyder le fluorure pour donner du fluor. Le chlore est principalement produit par l'électrolyse des solutions de chlorure de sodium. Ensuite, à l'anode, nous pouvons collecter du chlore gazeux. Le chlore est principalement important comme désinfectant dans la purification de l'eau. De plus, il est utile dans la fabrication d'une large gamme de produits de consommation comme les aliments, les insecticides, les peintures, les produits de pétrole, les plastiques, les médicaments, les textiles, les solvants.
Quelle est la différence entre le brome et le chlore?
Le brome est un élément chimique ayant le numéro atomique 35 et le symbole BR tandis que le chlore est un élément chimique ayant le numéro atomique 17 et le symbole CL. La principale différence entre le brome et le chlore est que le brome est moins réactif que le chlore.
De plus, les masses atomiques de brome et de chlore sont 79.904 AMU et 35.453 amu, respectivement. De plus, une autre différence entre le brome et le chlore est que le brome se produit comme un liquide de couleur brun rouge à température ambiante, tandis que le chlore se produit comme un gaz de couleur jaune-green.
Vous trouverez ci-dessous un résumé de la différence entre le brome et le chlore sous forme tabulaire.
Résumé - Bromine vs chlore
Le brome est un élément chimique ayant le numéro atomique 35 et le symbole BR. Le chlore est un élément chimique ayant un numéro atomique 17 et un symbole CL. En résumé, la principale différence entre le brome et le chlore est que le brome est moins réactif que le chlore.
Référence:
1. «Bromine - Informations sur les éléments, propriétés et utilisations | Tableau périodique.»Royal Society of Chemistry - Faire progresser l'excellence dans les sciences chimiques, disponible ici.
Image gracieuseté:
1. «Bromine-ampoule» par Jurii - (CC par 3.0) via Commons Wikimedia
2. «Chlore-échantillon» par Benjah-Bmm27 - Propre travaux (domaine public) via Commons Wikimedia


