Différence entre les cellules électrochimiques et les cellules galvaniques
Le différence clé entre les cellules électrochimiques et les cellules galvaniques est que La plupart des cellules électrochimiques ont tendance à convertir l'énergie électrique en énergie chimique, tandis que les cellules galvaniques ont tendance à convertir l'énergie chimique en énergie électrique.
Les réactions d'oxydation et de réduction jouent un rôle important dans l'électrochimie. Dans une réaction d'oxydation-réduction, les électrons sont transférés d'un réactif à un autre. La substance qui accepte les électrons est l'agent réducteur, tandis que la substance qui donne l'électron est l'agent oxydant. L'agent réducteur est responsable de la réduction de l'autre réactif tout en subissant une oxydation elle-même; Pour l'agent oxydant, c'est vice versa. Ces réactions se produisent dans deux demi-réactions pour montrer des oxydations et des réductions séparées; Ainsi, il montre le nombre d'électrons qui se déplacent dans ou hors.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une cellule électrochimique
3. Qu'est-ce qu'une cellule galvanique
4. Comparaison côte à côte - cellule électrochimique vs cellule galvanique sous forme tabulaire
5. Résumé
Qu'est-ce qu'une cellule électrochimique?
Une cellule électrochimique est une combinaison d'un agent réducteur et oxydant, qui sont physiquement séparés les uns des autres. Habituellement, nous faisons cette séparation par un pont de sel. Bien qu'ils soient physiquement séparés, les deux demi-cellules sont en contact chimique les uns avec les autres. Les cellules électrolytiques et galvaniques sont deux types de cellules électrochimiques.
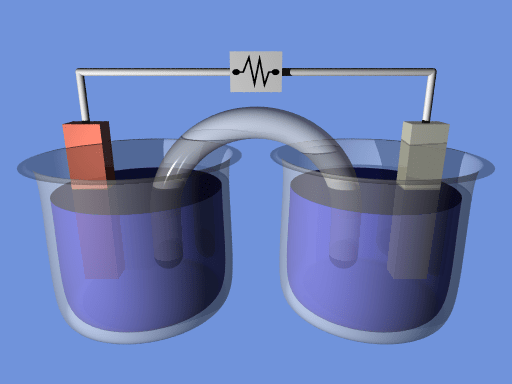
Les réactions d'oxydation-réduction ont lieu dans les cellules électrolytiques et galvaniques. Par conséquent, dans une cellule électrochimique, il y a deux électrodes comme anode et une cathode. Les deux électrodes se connectent à l'extérieur avec un voltmètre à haute résistance; Par conséquent, le courant ne transmet pas entre les électrodes. Par conséquent, ce voltmètre aide à maintenir une certaine tension entre les électrodes où les réactions d'oxydation ont lieu.

Figure 01: cellule électrochimique
La réaction d'oxydation a lieu sur l'anode, tandis que la réaction de réduction se déroule sur la cathode. Nous devons les plonger dans des solutions d'électrolyte séparées. Normalement, ces solutions sont des solutions ioniques liées au type d'électrode. Par exemple, nous plongeons des électrodes en cuivre dans une solution de sulfate de cuivre et des électrodes d'argent dans une solution de chlorure d'argent. Ces solutions sont différentes; Par conséquent, ils doivent être séparés. La façon la plus courante de les séparer est un pont de sel. Dans une cellule électrochimique, l'énergie potentielle de la cellule se convertit en courant électrique, que nous pouvons utiliser pour éclairer une ampoule ou pour faire d'autres travaux électriques.
Qu'est-ce qu'une cellule galvanique?
Les cellules galvaniques ou voltaïques stockent l'énergie électrique. Les batteries sont fabriquées à partir d'une série de cellules galvaniques pour produire une tension plus élevée. Les réactions aux deux électrodes dans les cellules galvaniques ont tendance à procéder spontanément. Lorsque les réactions ont lieu, il y a un flux d'électrons de l'anode à la cathode via un conducteur externe.
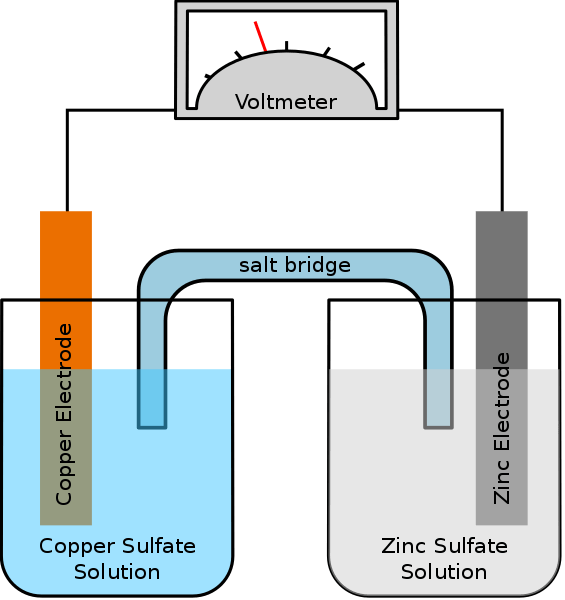
Figure 02: une cellule galvanique
Par exemple, si les deux électrodes sont en argent et en cuivre dans une cellule galvanique, l'électrode en argent est positive par rapport à l'électrode en cuivre. L'électrode en cuivre est l'anode, et elle subit une réaction d'oxydation et libère des électrons. Ces électrons vont à la cathode argentée via le circuit externe. Par conséquent, la cathode argentée subit une réaction de réduction. Une différence de potentiel est générée entre les deux électrodes, qui permettent le flux d'électrons. Voici la réaction de cellules spontanées de la cellule galvanique ci-dessus.
2 AG+ (aq) + cu (s) ⇌ 2ag (s) + cu2+ (aq)
Quelle est la différence entre les cellules électrochimiques et les cellules galvaniques?
Il existe deux types de cellules électrochimiques comme cellules électrolytiques et cellules galvaniques. La principale différence entre les cellules électrochimiques et les cellules galvaniques est que la plupart des cellules électrochimiques ont tendance à convertir l'énergie électrique en énergie chimique, tandis que les cellules galvaniques ont tendance à convertir l'énergie chimique en énergie électrique. De plus, dans la plupart des cellules électrochimiques telles que les cellules électrolytiques, l'anode est le terminal positif tandis que la cathode est le terminal négatif; Cependant, dans la cellule galvanique, l'anode est le terminal négatif et la cathode est le terminal positif.
De plus, une autre différence entre les cellules électrochimiques et les cellules galvaniques est que dans les cellules électrochimiques, telles que les cellules électrolytiques, des réactions chimiques non spontanées ont lieu, mais dans les cellules galvaniques, des réactions chimiques spontanées ont lieu.
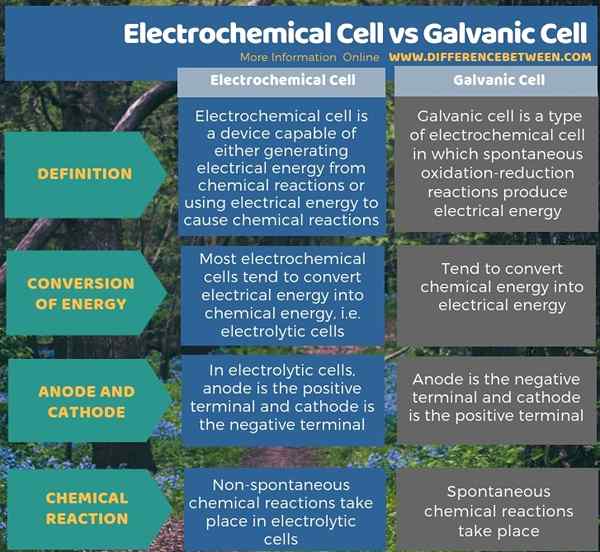
Résumé - cellule électrochimique VS et Galvanic
Il existe deux types de cellules électrochimiques comme cellules électrolytiques et cellules galvaniques. La principale différence entre les cellules électrochimiques et les cellules galvaniques est que la plupart des cellules électrochimiques ont tendance à convertir l'énergie électrique en énergie chimique, tandis que les cellules galvaniques ont tendance à convertir l'énergie chimique en énergie électrique.
Référence:
1.«Cellule électrochimique." Cellule électrochimique - un aperçu | Sujets ScienceDirect, Disponible ici.
Image gracieuseté:
1. «Electrochemcel» par Alksub au Wikipedia anglais (CC By-SA 3.0) via Commons Wikimedia
2. «Galvanic Cell» par Gringer - Fichier: Galvanische Zelle.png, par tinux (cc by-sa 3.0) via Commons Wikimedia


