Différence entre l'enthalpie du lien et l'enthalpie du réseau
Le différence clé Entre l'enthalpie du lien et l'enthalpie du réseau est que L'enthalpie des liaisons est la quantité d'énergie nécessaire pour décomposer une liaison chimique, tandis que l'énergie du réseau est la quantité d'énergie nécessaire pour former une mole d'un composé ionique des cations et des anions à l'état gazeux.
Ces deux termes décrivent l'échange d'énergie entre un système et ses environs. Bond L'enthalpie est l'opposé de l'enthalpie du réseau. Bond L'enthalpie explique la rupture des liens tandis que l'enthalpie du réseau explique la formation de liaisons. C'est pourquoi ils sont des phénomènes opposés les uns aux autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'enthalpie du lien
3. Qu'est-ce que l'enthalpie du réseau
4. Comparaison côte à côte - Enthalpie de liaison vs enthalpie du réseau dans la forme tabulaire
5. Résumé
Qu'est-ce que l'enthalpie du lien?
L'enthalpie des liaisons est la quantité d'énergie nécessaire pour décomposer une liaison chimique. Si nous appliquons la définition standard ici, il dit que l'enthalpie des liens est le changement d'enthalpie lorsqu'une taupe de liaisons est brisée en substance à 298 K. Étant donné que ce terme traite de la rupture des obligations, nous pouvons également le nommer en tant qu'énergie de dissociation des liaisons. Les autres synonymes incluent la résistance aux obligations et l'énergie de liaison moyenne.

Figure 01: Énergies de liaison de certaines liaisons chimiques
Si la valeur de l'enthalpie des liaisons est élevée, cela signifie que la liaison est très forte et difficile à décomposer. Par conséquent, cela nécessite plus d'énergie pour décomposer cette liaison particulière. En règle générale, les unités que nous utilisons pour la détermination de la valeur de l'enthalpie des liaisons sont kcal / mol (kilocalories par mole) ou kj / mol (kilojoules par mole).
Qu'est-ce que l'enthalpie du réseau?
Lattice L'enthalpie est la quantité d'énergie nécessaire pour former une mole d'un composé ionique dans des conditions standard en utilisant les cations et les anions à l'état gazeux. Puisque nous avons affaire à des réseaux cristallins ici, le terme enthalpie du réseau est utilisé pour les réseaux cristallins; En d'autres termes, il est appliqué pour des composés solides. C'est une mesure des forces qui lient les ions ensemble (les forces cohésives).

Figure 02: une structure de réseau
Généralement, l'énergie du réseau est importante dans la détermination de certaines propriétés physiques, y compris la solubilité des cristaux, la dureté et la volatilité. En règle générale, l'énergie du réseau est une énergie négative, mais l'enthalpie du réseau est une valeur positive. En effet.
Quelle est la différence entre l'enthalpie du lien et l'enthalpie du réseau?
Bond L'enthalpie est le processus opposé à l'enthalpie du réseau puisque l'enthalpie de Bond traite de la rupture de la liaison tandis que l'enthalpie du réseau traite de la formation de liaison. Par conséquent, la principale différence entre l'enthalpie des liaisons et l'enthalpie du réseau est que l'enthalpie des liaisons est la quantité d'énergie nécessaire pour décomposer une liaison chimique tandis que l'énergie du treillis est la quantité d'énergie nécessaire pour former une mole d'un composé ionique de la cations et anions dans l'état gazeux. L'enthalpie des liaisons est le changement d'enthalpie lorsqu'une taupe de liaisons est brisée en substance à 298 K. Par conséquent, nous pouvons également l'appeler comme l'enthalpie de la dissociation des liens.
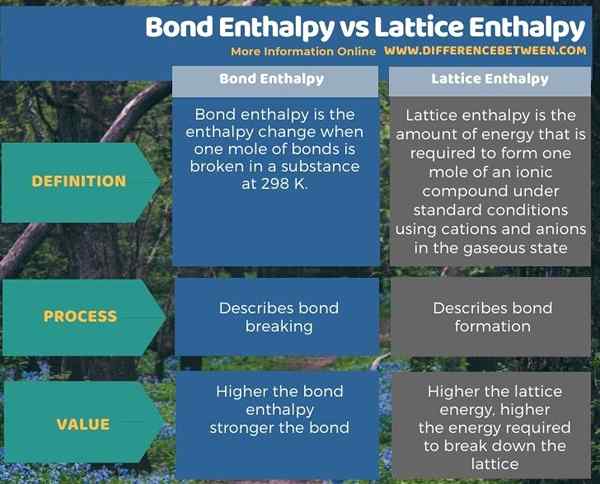
Résumé - Bond enthalpie vs enthalpie du réseau
Bond L'enthalpie traite de la rupture des liaisons tandis que l'enthalpie du réseau s'occupe de la formation de Bond. Par conséquent, la principale différence entre l'enthalpie des liaisons et l'enthalpie du réseau est que l'enthalpie des liaisons est la quantité d'énergie nécessaire pour décomposer une liaison chimique tandis que l'énergie du treillis est la quantité d'énergie nécessaire pour former une mole d'un composé ionique de la cations et anions dans l'état gazeux.
Référence:
1. Helmenstine, Anne Marie. «Définition de l'enthalpie de liaison en chimie."Thoughtco, août. 8, 2019, disponible ici.
2. «Énergie de liaison.»Wikipedia, Wikimedia Foundation, 4 novembre. 2019, disponible ici.
3. "Énergie réticulaire.»Wikipedia, Wikimedia Foundation, 11 novembre. 2019, disponible ici.
Image gracieuseté:
1. «Bond Energies» par Chem540F09Grp8 - Propre travaux (domaine public) via Commons Wikimedia
2. «Sodium-chlorure-3d-ionic» par Benjah-BMM27 (parler · contribs) - propre travail (domaine public) via Commons Wikimedia


