Différence entre le point d'ébullition et le point de fusion

Le différence clé entre le point d'ébullition et le point de fusion est que Le point d'ébullition est la température à laquelle un état liquide change à son état gazeux tandis que le point de fusion est la température à laquelle un état solide se transforme en un état liquide.
Il y a trois états de matière: l'état solide, l'état liquide et l'état gazeux. Les substances peuvent passer d'un état particulier à un autre si nous varions la température de cette substance. Lors du chauffage, généralement un changement solide dans son état liquide; Et après un nouveau chauffage, il se transforme en son état gazeux. En revanche, si nous refroidissons un composé gazeux, il se transforme à l'état liquide, suivi d'un état solide lors d'un refroidissement supplémentaire. Cependant, il existe des substances solides qui peuvent dire directement à l'état gazeux sans passer par l'état liquide (nous appelons cette sublimation), et vice versa.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le point d'ébullition
3. Qu'est-ce que le point de fusion
4. Comparaison côte à côte - point d'ébullition vs point de fusion dans la forme tabulaire
6. Résumé
Qu'est-ce que le point d'ébullition?
Le point d'ébullition est une propriété d'un liquide. Le point d'ébullition est la température à laquelle la pression de vapeur du liquide est égale à la pression externe sur le liquide. La pression est un facteur majeur qui affecte le point d'ébullition; la pression externe plus élevée sur une substance, le point d'ébullition est élevé. Ainsi, c'est la théorie simple derrière les autocuiseurs. Un autocuiseur est une cuisinière qui emprisonne la vapeur de l'eau chauffée à l'intérieur. La quantité élevée de vapeur à l'intérieur du récipient rend la pression externe sur le liquide plus haut. Par conséquent, cette haute pression entraîne un point d'ébullition plus élevé. De plus, cette théorie est très utile, en particulier dans des altitudes plus élevées. Habituellement, l'eau bouillonne à 1000C. Étant donné que la pression atmosphérique est plus faible à des altitudes plus élevées, l'eau bouillera entre 80 0C - 90 0C. Et cela provoquera des repas insuffisants.

Figure 01: eau bouillante au point d'ébullition
Un liquide se fasse en bout lorsqu'il dépasse sa température de saturation à la pression de saturation correspondante. La température de saturation est la température correspondant à l'énergie thermique la plus élevée que le liquide peut tenir sans changer son état en vapeur à la pression donnée. La température de saturation est également équivalente au point d'ébullition du liquide. L'ébullition se produit lorsque l'énergie thermique du liquide est suffisante pour briser les liaisons intermoléculaires. Le point d'ébullition normal est la température de saturation à la pression atmosphérique. De plus, le point d'ébullition ne varie que entre le point triple et le point critique du liquide.
Qu'est-ce que le point de fusion?
Le point de fusion est une propriété d'un solide. Le point de fusion est la température à laquelle le solide se transforme en liquide. Plus précisément, le point de fusion est la température lorsque l'état liquide et l'état solide restent en équilibre thermique les uns avec les autres.

Figure 2: Merceau de glace
Le point de fusion et le point de congélation d'une substance peuvent ne pas être les mêmes. Par exemple, l'agar fond à 85 0C, mais cela se solidifie à 31 ans 0C à 40 0C. Les liaisons intermoléculaires et le poids moléculaire définissent principalement le point de fusion. Certains solides comme le verre n'ont pas de point de fusion spécifique. Ils subissent simplement une transition en douceur du solide au liquide.
Quelle est la différence entre le point d'ébullition et le point de fusion?
Point d'ébullition et point de fusion sont les propriétés des substances. La principale différence entre le point d'ébullition et le point de fusion est que le point d'ébullition est la température à laquelle un état liquide se transforme à son état gazeux tandis que le point de fusion est la température à laquelle un état solide se transforme en un état liquide. Par conséquent, le point d'ébullition est défini pour un état liquide tandis que le point de fusion est défini pour un état solide.
L'info-graphique ci-dessous présente plus de détails sur la différence entre le point d'ébullition et le point de fusion.
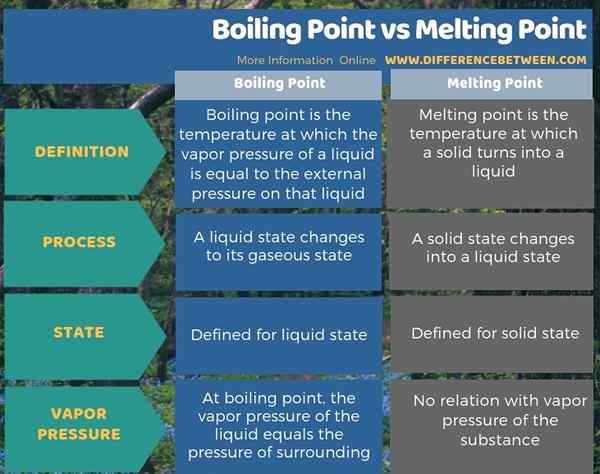
Résumé - point d'ébullition vs point de fusion
Le point d'ébullition et le point de fusion sont les propriétés de la matière. Ils jouent un rôle très important lorsqu'il s'agit de décrire un matériel. La principale différence entre le point d'ébullition et le point de fusion est que le point d'ébullition est la température à laquelle un état liquide se transforme à son état gazeux tandis que le point de fusion est la température à laquelle un état solide se transforme en un état liquide.
Référence:
1. "Point d'ébullition.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 février. 2018, disponible ici.
2."Point de fusion.»Wikipedia, Wikimedia Foundation, 12 mai 2019, disponible ici.
Image gracieuseté:
1. «Eau bouillante» par Scott Akerman (CC par 2.0) via Flickr
2. «Melting Ice Thermomètre» par Ulflund - Propre travaux (CC0) via Commons Wikimedia


