Différence entre l'absorption atomique et les émissions atomiques
Le différence clé entre l'absorption atomique et l'émission atomique est que L'absorption atomique décrit comment les atomes absorbent certaines longueurs d'onde du rayonnement électromagnétique tandis que l'émission atomique décrit comment les atomes émettent certaines longueurs d'onde.
L'absorption et l'émission d'un atome aident à identifier les atomes et à fournir de nombreux détails à leur sujet. Lorsque les spectres d'absorption et d'émission d'une espèce sont assemblés, ils forment un spectre continu. Par conséquent, l'absorption atomique et les émissions atomiques sont complémentaires.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'absorption atomique
3. Qu'est-ce que l'émission atomique
4. Comparaison côte à côte - Absorption atomique vs émission atomique sous forme tabulaire
5. Résumé
Qu'est-ce que l'absorption atomique?
Un composé coloré est visible à nos yeux dans cette couleur particulière car il absorbe la lumière de la gamme visible. En fait, il absorbe la couleur complémentaire de la couleur que nous voyons. Par exemple, nous voyons un objet comme vert car il absorbe la lumière violette de la plage visible. Ainsi, le violet est la couleur complémentaire du vert. De même, les atomes ou les molécules absorbent également certaines longueurs d'onde du rayonnement électromagnétique (ces longueurs d'onde ne sont pas nécessairement dans la plage visible). Lorsqu'un faisceau de rayonnement électromagnétique passe à travers un échantillon contenant des atomes gazeux, les atomes n'absorbent que quelques longueurs d'onde. L'énergie absorbée aide à exciter les électrons de terre aux niveaux supérieurs dans l'atome. Nous appelons cette transition électronique. La différence d'énergie entre les deux niveaux est fournie par les photons dans le rayonnement électromagnétique.
Étant donné que cette différence d'énergie est discrète et constante, le même type d'atomes absorbera toujours les mêmes longueurs d'onde du rayonnement donné. Un spectre d'absorption est un tracé dessiné entre l'absorbance et la longueur d'onde. Parfois, au lieu de la longueur d'onde, la fréquence ou le nombre d'ondes peut également être utilisé dans l'axe X. La valeur d'absorption du journal ou la valeur de transmission est également utilisée pour l'axe y à certaines occasions.
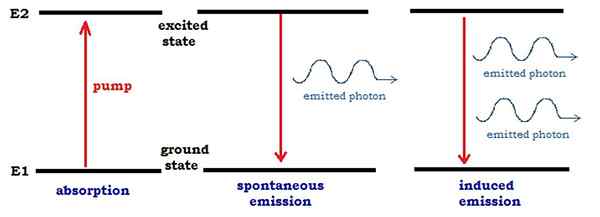
Figure 01: Absorption et émission dans un schéma simple
Après que la lumière passe par un échantillon atomique, si nous l'enregistrons, nous pouvons l'appeler un spectre atomique. Il montre la caractéristique d'un type d'atome. Par conséquent, nous pouvons l'utiliser pour identifier ou confirmer l'identité d'une espèce particulière. Et, ce type de spectre aura un certain nombre de lignes d'absorption très étroites.
Qu'est-ce que l'émission atomique?
L'émission atomique est l'émission du rayonnement électromagnétique des atomes. Les atomes peuvent être excités à un niveau d'énergie plus élevé si la quantité d'énergie requise est fournie à l'extérieur. La durée de vie d'un état excité est généralement courte. Par conséquent, ces espèces excitées doivent libérer l'énergie absorbée et revenir à l'état fondamental. Nous appelons cette relaxation.
La libération d'énergie peut avoir lieu sous forme de rayonnement électromagnétique, de chaleur ou des deux types. Le tracé de l'énergie libérée en fonction de la longueur d'onde donne un spectre d'émission.

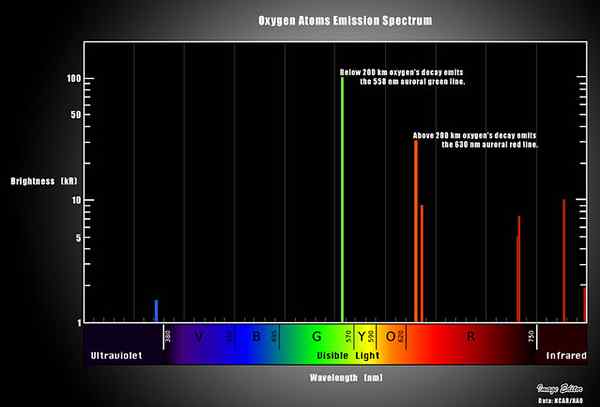
Figure 02: Spectre d'émission de l'oxygène
Chaque élément a un spectre d'émission unique car ils ont un spectre d'absorption unique. Par conséquent, nous pouvons caractériser le rayonnement d'une source par émission. Les spectres de ligne se produisent lorsque les espèces rayonnantes sont des particules atomiques individuelles qui sont bien séparées dans un gaz.
Quelle est la différence entre l'absorption atomique et les émissions atomiques?
L'absorption atomique est l'absorption du rayonnement électromagnétique par les atomes tandis que l'émission atomique est l'émission du rayonnement électromagnétique des atomes. Ainsi, la principale différence entre l'absorption atomique et les émissions atomiques est que l'absorption atomique décrit comment les atomes absorbent certaines longueurs d'onde à partir du rayonnement électromagnétique alors que l'émission atomique décrit comment les atomes émettent certaines longueurs d'onde.
De plus, l'absorption atomique nécessite une source qui peut émettre un rayonnement tandis que l'émission atomique se produit même en l'absence d'une source qui émet un rayonnement. De plus, en absorbant, les électrons dans un atome sont excités à un niveau d'énergie plus élevé. Par émission, les électrons excités reviennent à un niveau inférieur. Par conséquent, il s'agit d'une autre différence significative entre l'absorption atomique et les émissions atomiques.

Résumé - Absorption atomique vs émission atomique
L'absorption atomique et les émissions atomiques sont deux phénomènes opposés qui ont lieu simultanément. La principale différence entre l'absorption atomique et les émissions atomiques est que l'absorption atomique décrit comment les atomes absorbent certaines longueurs d'onde à partir du rayonnement électromagnétique tandis que l'émission atomique décrit comment les atomes émettent certaines longueurs d'onde.
Référence:
1. Lindon, John C., et al. Encyclopédie de spectroscopie et de spectrométrie. Elsevier, 2017.
2. «Absorption (rayonnement électromagnétique)." Wikipédia, Fondation Wikimedia, 3 mai 2019, disponible ici.
Image gracieuseté:
1. «Système à deux niveaux» par Philipposc - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «11 Spectre d'oxygène» par l'éditeur d'image (CC par 2.0) via Flickr


