Différence entre les acides binaires et les oxyacides

Le différence clé entre les acides binaires et les oxyacides est que le Les oxyacides contiennent au moins un atome d'oxygène dans la molécule, mais les acides binaires ne contiennent pas d'oxygène. Les acides binaires ont de l'hydrogène et un autre élément non métal dans la molécule.
Nous pouvons définir un acide de plusieurs manières selon divers scientifiques. Selon la définition d'Arrhenius ou de Bronsted-Lowry, un composé doit avoir un atome d'hydrogène et devrait être en mesure de le donner en tant que proton si nous voulons le nommer comme acide. Mais selon Lewis, il y a des molécules, qui ne possèdent pas d'hydrogène, mais peuvent agir comme un acide, je.e. Bcl3 est un acide Lewis, car il peut accepter une paire d'électrons. Quels que soient les types ci-dessus, nous pouvons décrire et classer les acides de bien d'autres manières. Par exemple, en tant qu'acides inorganiques et organiques en fonction des éléments qu'ils ont et aussi en tant qu'acides binaires et oxyacides.
CONTENU
1. Aperçu et différence clé
2. Que sont les acides binaires
3. Que sont les oxyacides
4. Comparaison côte à côte - acides binaires vs oxyacides sous forme tabulaire
5. Résumé
Que sont les acides binaires?
Les acides binaires sont des molécules, qui contiennent deux éléments; Un élément est l'hydrogène, et l'autre est un élément non métal, qui est plus électronégatif que l'hydrogène. Par conséquent, les acides binaires peuvent donner H+ ions dans des médias aqueux. HCl, HF, HBR et H2S sont quelques-uns des exemples d'acides binaires. Ceux-ci montrent différentes propriétés lorsqu'elles sont sous forme pure et lorsqu'elles sont dans des médias aqueux.
Dans la nomenclature des acides binaires, si l'acide est sous forme pure, le nom commence par «l'hydrogène», et le nom anionique se termine par «-ide». Par exemple, nous pouvons nommer HCL comme chlorure d'hydrogène. Les noms de solutions aqueux d'acide binaire commencent par «hydro», et le nom de l'anion se termine par «IC». Là, nous ajoutons le mot «acide» à la fin du nom. Par exemple, la solution aqueuse HCL est de l'acide chlorhydrique.

Figure 01: HCL est un acide binaire
De plus, nous pouvons déterminer la force de l'acide binaire par la façon dont il donne facilement H+ au milieu. Si la liaison entre l'hydrogène et l'autre élément est faible, elle peut facilement donner le proton; Ainsi, l'acide est plus fort. La stabilité de l'anion formé affecte également la capacité de don de protons. Par exemple, Hi est un acide plus fort que HCl, car je- L'anion est plus stable que le CL- anion.
Que sont les oxyacides?
Les oxyacides sont des acides qui contiennent un atome d'oxygène dans la molécule. HNO3, H2DONC4, H2CO3, H3Pote4, Ch3COOH est quelques-uns des oxyacides communs. Autre que l'oxygène, il y a au moins un autre élément et au moins un atome d'hydrogène dans la molécule.
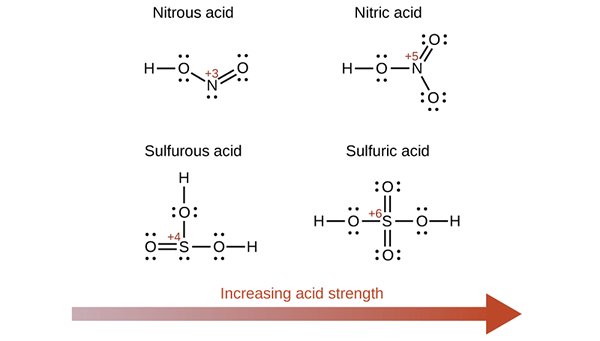
Figure 02: Certaines oxyacides et leur force acide
La capacité de donner un ou plusieurs protons est essentielle pour faire de l'élément un acide. L'hydrogène de l'oxyacide se lie à l'atome d'oxygène. Par conséquent, dans ces acides, nous pouvons déterminer l'acidité par l'électronégativité de l'atome central et le nombre d'atomes d'oxygène.
Quelle est la différence entre les acides binaires et les oxyacides?
Les acides binaires sont des molécules, qui contiennent deux éléments; Un élément est l'hydrogène, et l'autre est un élément non métallique. Tandis que les oxyacides sont des acides qui contiennent un atome d'oxygène dans la molécule. Par conséquent, la principale différence entre les acides binaires et les oxyacides est que les oxyacides contiennent au moins un atome d'oxygène dans la molécule, mais les acides binaires ne contiennent pas d'oxygène.
Comme autre différence significative entre l'acide binaire et les oxyacides, dans les oxyacides, le proton qui est donné est attaché aux atomes d'oxygène. Dans les acides binaires, les hydrogènes sont attachés à l'autre élément non métallique.
Vous trouverez ci-dessous une infographie sur la différence entre l'acide binaire et les oxyacides.

Résumé - Acides binaires vs oxyacides
Les acides binaires et les oxyacides sont deux types de composés acides. La principale différence entre les acides binaires et les oxyacides est que les oxyacides contiennent au moins un atome d'oxygène dans la molécule et les acides binaires ne contiennent pas d'oxygène. Les acides binaires ont de l'hydrogène et un autre élément non métal dans la molécule.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition et exemples oxyacides.”Thoughtco, Jun. 22, 2018. Disponible ici
2. Helmenstine, Anne Marie, Ph.D. «Définition de l'acide binaire.”Thoughtco, Jun. 22, 2018. Disponible ici
Image gracieuseté:
1.«CNX Chem 14 03 oxyacide» par OpenStax (CC par 4.0) via Commons Wikimedia


