Différence entre équation équilibrée et équation squelette
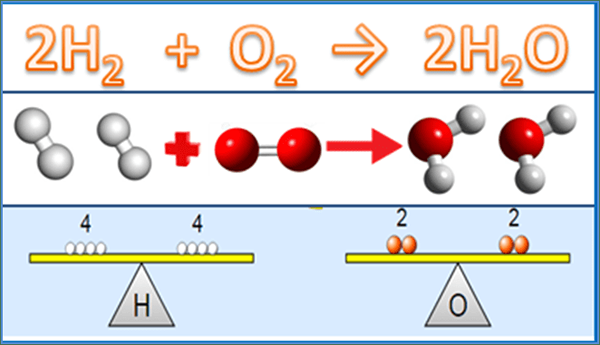
La principale différence entre l'équation équilibrée et l'équation du squelette est que L'équation équilibrée donne le nombre réel de molécules de chaque réactif et produit impliqué dans la réaction chimique tandis que l'équation squelette ne donne que les réactifs de la réaction.
Une équation chimique est une représentation d'une réaction chimique. Cela signifie; L'équation chimique donne également les réactifs de la réaction, le produit final et la direction de la réaction. Il existe deux types d'équations comme équation équilibrée et équation squelette.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une équation équilibrée
3. Qu'est-ce qu'une équation squelette
4. Comparaison côte à côte - équation équilibrée vs équation squelette sous forme tabulaire
5. Résumé
Qu'est-ce qu'une équation équilibrée?
Une équation chimique équilibrée donne le nombre réel de chaque réactif qui réagit entre eux et le nombre de molécules de produit formées. Il s'agit d'une équation entièrement détaillée qui donne les rapports entre les réactifs et les produits. Lors du calcul d'un paramètre tel que la quantité de produit que nous obtenons de la réaction, nous devons utiliser l'équation chimique équilibrée; Sinon, nous ne saurons pas combien de réactifs ont réagi pour donner la quantité de produit.

Cependant, dans les calculs thermodynamiques, cette équation ne fonctionne pas lors de la détermination de l'ordre de réaction car nous devons déterminer l'ordre de réaction essentiellement via une méthode expérimentale. Dans une équation chimique équilibrée, les valeurs devant la molécule sont appelées «coefficient stoechiométrique»; La stoechiométrie est la relation numérique entre les réactifs et les produits.
2NA2O ⟶ 4NA + O2
La réaction ci-dessus est un exemple d'une équation chimique équilibrée. Il donne la décomposition de l'oxyde de sodium (Na2O). L'équation normale ou l'équation squelette de cette réaction est na2O ⟶ na + o2. Lors de l'équilibrage de l'équation, nous pouvons utiliser deux méthodes: la méthode d'inspection et la méthode du numéro d'oxydation.
La méthode d'inspection comprend l'équilibre de l'équation chimique en regardant les réactifs et les produits. Dans cette réaction, l'oxyde de sodium est le réactif, et il a deux atomes de sodium et un atome d'oxygène par molécule. Mais du côté du produit, il y a un atome de sodium et deux atomes d'oxygène. Par conséquent, nous pouvons d'abord ajouter un coefficient stoechiométrique au côté réactif; c'est 2. Ensuite, du côté réactif, il y a quatre atomes de sodium et deux atomes d'oxygène. Puisqu'il existe également deux atomes d'oxygène dans le côté du produit, nous pouvons simplement ajouter «4» comme coefficient stoechiométrique de sodium du côté produit pour équilibrer cette équation. Maintenant, le nombre d'atomes de chaque côté est égal; Ainsi, nous obtenons une équation chimique équilibrée.
Qu'est-ce qu'une équation squelette?
L'équation squelette donne les types de réactifs impliqués dans la réaction chimique et les produits finaux. Cependant, cela ne donne pas le rapport exact entre les réactifs et les produits. Par conséquent, les détails importants que nous pouvons obtenir d'une équation squelette sont les réactifs de la réaction, les produits de la réaction et la direction de la réaction. Pour la réaction ci-dessus, la réaction du squelette est la suivante;
N / A2O ⟶ na + o2
Quelle est la différence entre l'équation équilibrée et l'équation du squelette?
La principale différence entre l'équation équilibrée et l'équation du squelette est que l'équation équilibrée donne le nombre réel de molécules de chaque réactif et produit impliqué dans la réaction chimique, tandis que l'équation squelette ne donne que les réactifs de la réaction. De plus, une équation équilibrée peut contenir ou non des coefficients stoechiométriques tandis qu'une équation squelette n'a pas de coefficients stoechiométriques. Par exemple, l'équation chimique équilibrée pour la décomposition de l'oxyde de sodium est 2NA2O ⟶ 4NA + O2 tandis que l'équation du squelette est na2O ⟶ na + o2.
L'infographie ci-dessous résume la différence entre l'équation équilibrée et l'équation du squelette.

Résumé - Équation équilibrée vs équation squelette
L'équation équilibrée et l'équation squelette sont deux façons d'écrire une équation chimique pour une réaction chimique particulière. En résumé, la principale différence entre l'équation équilibrée et l'équation du squelette est que l'équation équilibrée donne le nombre réel de molécules de chaque réactif et produit impliqué dans la réaction chimique, tandis que l'équation squelettique ne donne que les réactifs de la réaction.
Référence:
1. Helmenstine, Anne Marie. «Définition et exemples de l'équation équilibrée.”Thoughtco, sept. 17, 2019, disponible ici.
Image gracieuseté:
1. «Équation de l'équation chimique - Formation de l'eau» par KVR.Lohith - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


