Différence entre le nombre quantique azimutal et principal
Le différence clé entre le nombre quantique azimutal et principal est que Le nombre quantique azimutal décrit le moment angulaire d'un électron dans un atome tandis que le principal numéro quantique décrit la taille d'une orbitale électronique.
Les nombres quantiques sont des valeurs qui sont importantes pour décrire les niveaux d'énergie d'un atome. Il y a quatre nombres quantiques que nous pouvons utiliser pour décrire la position d'un électron dans un atome. Ils sont le principal numéro quantique, le nombre quantique azimutal, le nombre quantique magnétique et le numéro quantique de spin.
CONTENU
1. Aperçu et différence clé
2. Quel est le numéro quantique azimutal
3. Quel est le principal numéro quantique
4. Comparaison côte à côte - Numéro quantique azimutal vs principal dans la forme tabulaire
5. Résumé
Quel est le numéro quantique azimutal?
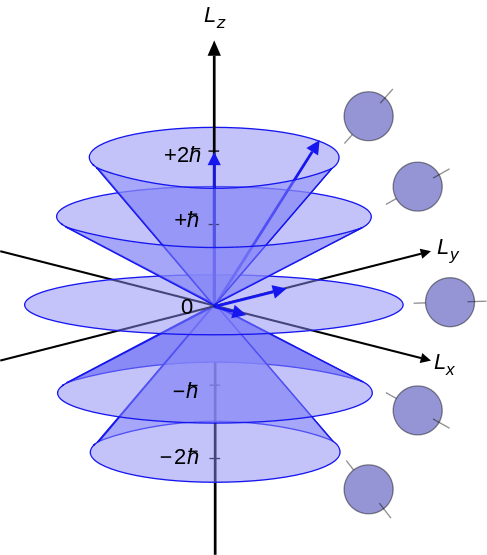
Le nombre quantique azimutal est le nombre quantique qui décrit le moment angulaire d'un électron dans un atome. Par conséquent, nous pouvons également l'appeler le numéro quantum de moment angulaire orbital. La lettre "l”Désigne le numéro quantique azimutal. De plus, ce nombre quantique détermine les formes d'une orbitale dans laquelle un électron existe. C'est le deuxième de l'ensemble de quatre nombres quantiques. Ainsi, nous pouvons également le nommer comme deuxième numéro quantique (car les quatre nombres quantiques décrivent l'état quantique d'un électron dans un atome). L'équation qui peut relier le nombre quantique azimutal avec le moment angulaire est la suivante:
L2Ψ =H2l(l+1) ψ
Où l2 est l'opérateur de moment angulaire orbital, ψ est une fonction d'onde de l'électron et H est la constante de la planche réduite. Ici, je est toujours un entier positif. Selon la mécanique quantique, chaque niveau d'énergie a des sous-coquilles différentes. Ces sous-coquilles diffèrent les unes des autres dans leur forme et leur orientation. Les sous-coquilles d'un niveau d'énergie sont nommées comme -je, 0 et +l.
| Numéro azimutal | Dénotation | Nombre d'orbitales | Nombre maximum d'électrons |
| 0 | s | 1 | 2 |
| 1 | p | 3 (= -1, 0, +1) | 6 |
| 2 | d | 5 (= -2, -1, 0, +1, +2) | dix |
| 3 | F | 7 (= -3, -2, -1, 0, +1, +2, +3) | 14 |

Figure 02: Nombres quantiques azimutaux allant de -l, 0 à + L
Quel est le principal numéro quantique?
Un nombre quantique principal est un nombre quantique qui décrit le principal niveau d'énergie dans lequel un électron existe. Nous pouvons le désigner comme «N». Car il s'agit du premier des quatre nombres quantiques différents; Nous pouvons également l'appeler le premier numéro quantique. La valeur du nombre quantique principal est un entier positif à partir de 1, i.e. n = 1, 2, 3,…
La valeur du nombre quantique principal est élevée, l'énergie d'un électron est élevée; Ainsi, l'électron est vaguement lié à l'atome. Cela signifie; Les valeurs «N» élevées se réfèrent à des niveaux d'énergie plus élevés. De plus, pour chaque valeur «N», il existe des valeurs distinctes pour le nombre quantique azimutal, le nombre quantique magnétique et le numéro quantique de spin. C'est parce que chaque niveau d'énergie a ses propres sous-coquilles, orbitales et paires d'électrons, respectivement.
Quelle est la différence entre le nombre quantique azimutal et principal?
Les nombres quantiques sont des valeurs qui sont importantes pour décrire les niveaux d'énergie d'un atome. Il y a quatre nombres quantiques différents, et les deux premiers sont le principal numéro quantique et numéro quantique azimutal. La principale différence entre le nombre quantique azimutal et principal est que le nombre quantique azimutal décrit le moment angulaire d'un électron dans un atome, tandis que le principal numéro quantique décrit la taille d'une orbite électronique. Nous pouvons désigner le nombre quantique azimutal comme «l»Et le principal numéro quantique comme« n ».
De plus, le nombre quantique azimutal décrit le moment angulaire et la forme d'une orbitale, tandis que le principal numéro quantique décrit le niveau d'énergie dans lequel un électron existe.
L'infographie ci-dessous résume la différence entre le nombre quantique azimutal et principal.
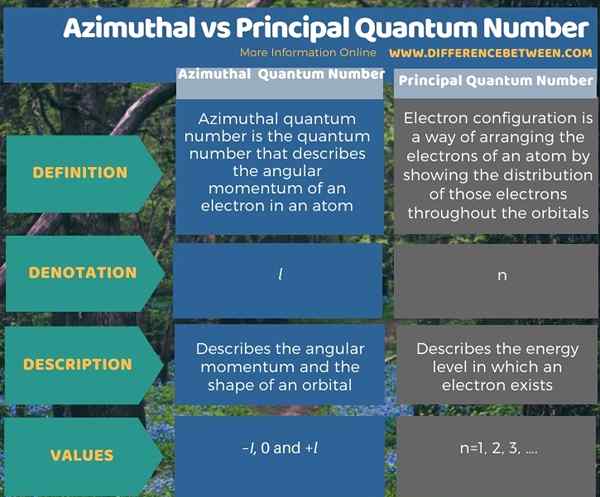
Résumé - Nombre quantique azimutal vs principal
Les nombres quantiques sont des valeurs qui décrivent les niveaux d'énergie d'un atome. Il y a quatre nombres quantiques différents, et les deux premiers sont le principal numéro quantique et numéro quantique azimutal. La principale différence entre le nombre quantique azimutal et principal est que le nombre quantique azimutal décrit le moment angulaire d'un électron dans un atome, tandis que le principal numéro quantique décrit la taille d'une orbite électronique.
Référence:
1. Helmenstine, Anne Marie. «Définition du numéro quantique azimutal.”Thoughtco, Jun. 22, 2018, disponible ici.
2. Helmenstine, Anne Marie. «Définition du numéro quantique principal."Thoughtco, nov. 6, 2019, disponible ici.
Image gracieuseté:
1. «Modèle vectoriel du moment angulaire orbital» par Maschen - propre travail (domaine public) via Commons Wikimedia


