Différence entre les interactions ioniques et électrostatiques
Le différence clé entre les interactions ioniques et électrostatiques est que Les interactions ioniques décrivent la force d'attraction entre deux espèces ioniques opposées. Pendant ce temps, les interactions électrostatiques décrivent la force d'attraction entre deux espèces complètement ou partiellement ionisées avec des charges opposées.
Les interactions ioniques et électrostatiques sont des concepts chimiques très importants qui sont utiles pour déterminer l'accumulation de molécules. Ceux-ci sont également nommés comme des obligations non covalentes. Les liaisons chimiques covalentes se forment due au partage d'électrons entre les atomes. Mais, les liaisons non covalentes se forment en raison de l'attraction des espèces chargées qui ont des charges électriques opposées.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les interactions ioniques
3. Que sont les interactions électrostatiques
4. Comparaison côte à côte - interactions ioniques vs électrostatiques sous forme tabulaire
5. Résumé
Quelles sont les interactions ioniques?
Les interactions ioniques sont des liaisons ioniques où deux espèces ioniques à charge opposée s'attirent électrostatiquement. C'est un type de liaison non covalente. De plus, il implique des espèces chimiques complètement chargées (espèces non chargées partiellement). Il s'agit du principal type de liaison chimique qui se produit dans les composés ioniques.
Les ions sont des atomes ou un groupe d'atomes qui ont gagné ou éliminé les électrons; Cela les rend espèces chargées électriquement. Les anions et les cations sont les deux types d'ions. Des anions formés en raison du gain d'électrons tandis que les cations sont formées en raison du retrait d'électrons. Par conséquent, les anions sont chargés négativement en raison de la présence d'électrons en excès tandis que les cations sont positivement chargées en raison du manque d'électrons pour neutraliser la charge des protons.
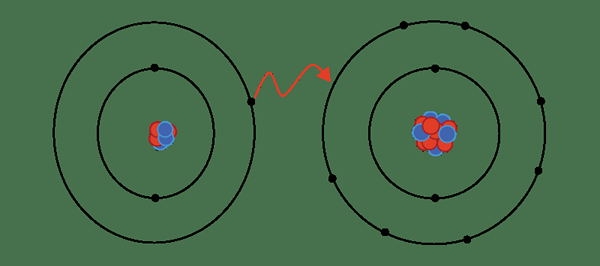
Une liaison ionique se forme lorsque l'électron retiré d'un atome (ou un groupe d'atomes) afin de former un cation est obtenu par un autre atome (ou groupe d'atomes), ce qui conduit à la formation d'un anion. Dans le sens le plus simple, une liaison ionique se forme lorsqu'un électron est retiré d'un métal, et un non-métal attrape cet électron pour former un anion.

Figure 01: Formation d'une liaison ionique
Cependant, toutes les liaisons ioniques ont un certain degré de caractéristiques covalentes car aucun atome ne peut complètement éliminer un électron. Par conséquent, nous devons comprendre que le terme interaction ionique fait référence au moment où le caractère ionique est plus grand par rapport au caractère covalent.
Presque tous les composés ioniques sont des composés solides car les interactions ioniques sont suffisamment fortes pour maintenir les anions et les cations liés ensemble. Cependant, les composés ioniques fondus peuvent conduire de l'électricité car il a des ions qui peuvent porter des charges. De plus, la force élevée des interactions ioniques conduit les composés ioniques à avoir des points de fusion très élevés.
Que sont les interactions électrostatiques?
Les interactions électrostatiques sont un type de forces d'attraction dans lesquelles les espèces complètes ou partiellement ioniques sont attirées les unes contre les autres. De plus, ce terme comprend à la fois des forces attrayantes et répulsives entre les espèces ioniques, i.e. Les ions chargés à charge opposée sont attirés les uns par les autres tandis que les mêmes charges se repoussent les unes des autres. Ceux-ci sont également nommés comme des liaisons non covalentes car la force d'attraction n'inclut aucun partage d'électrons entre les atomes. Il existe trois types différents d'interactions électrostatiques: les interactions ioniques, la liaison hydrogène et la liaison halogène.
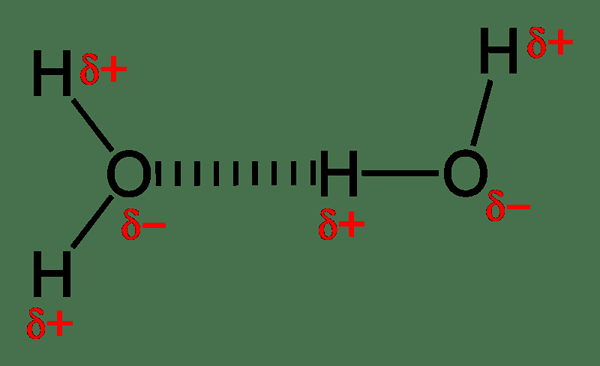
Figure 02: La liaison hydrogène est un type d'interaction électrostatique
L'interaction ionique comprend la force d'attraction entre les espèces chimiques complètement ionisées ayant des charges opposées, e.g. Les anions attirent les cations. Ces interactions provoquent la formation de composés ioniques. Ces forces d'interaction sont très fortes; Par conséquent, des composés ioniques existent dans l'état solide. La liaison hydrogène est un autre type d'interaction électrostatique où nous pouvons observer une interaction dipôle-dipole. Cette attraction existe entre un atome d'hydrogène (qui est partiellement positif) et un atome hautement électronégatif (qui est partiellement négatif). De plus, la liaison halogène est également comme une liaison hydrogène, mais la différence est l'interaction qui existe entre un halogène et un électrophile.
Quelle est la différence entre les interactions ioniques et électrostatiques?
Les interactions ioniques et les interactions électrostatiques sont des liaisons chimiques non covalentes. Ceux-ci sont très importants pour décrire la formation de différentes molécules. La principale différence entre les interactions ioniques et électrostatiques est que les interactions ioniques décrivent la force d'attraction entre deux espèces ioniques opposées, tandis que les interactions électrostatiques décrivent la force d'attraction entre deux espèces complètement ou partiellement ionisées avec des charges opposées.
En dessous de l'infographie résume la différence entre les interactions ioniques et électrostatiques.

Résumé - Interactions ioniques vs électrostatiques
Les interactions ioniques et les interactions électrostatiques sont des liaisons chimiques non covalentes. Ceux-ci sont très importants pour décrire la formation de différentes molécules. La principale différence entre les interactions ioniques et électrostatiques est que les interactions ioniques décrivent la force d'attraction entre deux espèces ioniques opposées, tandis que les interactions électrostatiques décrivent la force d'attraction entre deux espèces complètement ou partiellement ionisées avec des charges opposées.
Référence:
1. Helmenstine, Anne Marie. «Définition des obligations ioniques."Thoughtco, Jan. 26, 2019, disponible ici.
2. Helmenstine, Anne Marie. «Définitions de chimie: quelles sont les forces électrostatiques?”Thoughtco, oct. 5, 2019, disponible ici.
Image gracieuseté:
1. «Bondage ionique» par Eliseetc / Vectorisé à partir de la liaison ionique.PNG - propre travail (CC BY-SA 3.0) via Commons Wikimedia
2. «Hydrogène-liaison dans l'eau-2D» (domaine public) via Commons Wikimedia


