Différence entre l'hydrogène atomique et l'hydrogène naissant
Différence clé - Hydrogène atomique vs hydrogène naissant
L'hydrogène est un élément chimique. C'est le premier élément chimique qui peut être trouvé dans le tableau périodique des éléments (dans le groupe 1, période 1). Chaque élément chimique a son propre symbole. Le symbole chimique de l'hydrogène est h. Tout isotope d'hydrogène contient un proton dans son noyau atomique. Par conséquent le nombre atomique d'hydrogène est 1. C'est l'élément le plus léger que l'on trouve sur Terre. L'hydrogène atomique et l'hydrogène naissant sont deux termes utilisés en chimie pour identifier le même élément d'hydrogène dans différentes applications. La principale différence entre l'hydrogène atomique et l'hydrogène naissant est que Un atome d'hydrogène ou d'hydrogène obtenu par dissociation de l'hydrogène moléculaire est connu sous le nom d'hydrogène atomique alors que l'hydrogène naissant se réfère à l'hydrogène libéré lors d'une réaction chimique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hydrogène atomique
3. Qu'est-ce que l'hydrogène naissant
4. Similitudes entre l'hydrogène atomique et l'hydrogène naissant
5. Comparaison côte à côte - hydrogène atomique vs hydrogène naissant sous forme tabulaire
6. Résumé
Qu'est-ce que l'hydrogène atomique?
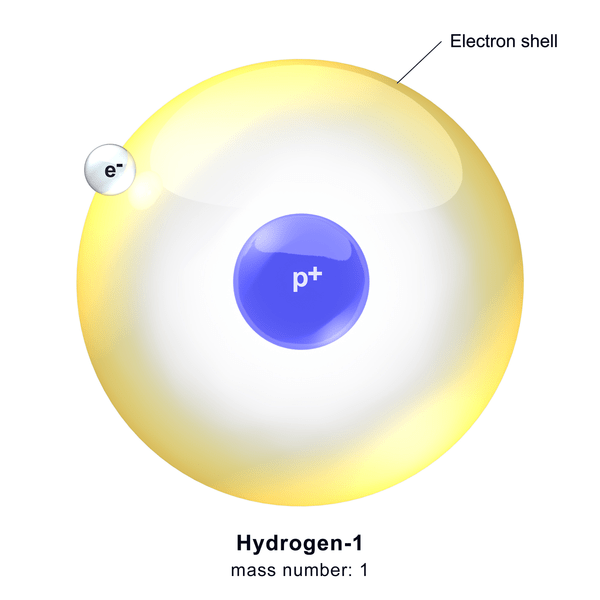
L'hydrogène obtenu par dissociation de l'hydrogène moléculaire est connu sous le nom d'hydrogène atomique. Par conséquent l'hydrogène atomique est un hydrogène isolé. Un atome d'hydrogène contient un proton chargé positivement dans le noyau et un électron chargé négativement lié au noyau via les forces de Coulomb. Lors de l'examen de la survenue d'hydrogène atomique, environ 70 à 75% de la matière normale dans l'univers est l'hydrogène atomique.

Figure 1: Structure atomique du protium
L'hydrogène atomique est très rare sur la croûte de la Terre en raison de sa forte réactivité et de sa énergie. L'hydrogène atomique a tendance à former l'hydrogène moléculaire (H2) ou d'autres composés afin d'obtenir un état d'énergie inférieur qui est stable.
L'hydrogène atomique peut être trouvé dans trois isotopes majeurs. Les isotopes sont des atomes du même élément chimique qui ont le même nombre de protons mais des nombres différents de neutrons (ou neutrons sont absents). Il y a trois principaux isotopes: Protium, Deuterium et Tritium. Le protium n'a pas de neutrons dans son noyau atomique; Le deutérium a un neutron tandis que le tritium en a deux. Protium est l'isotope le plus abondant.
Le seul électron dans l'hydrogène atomique est occupé dans une orbite. L'hydrogène atomique est capable de former des liaisons covalentes sigma, mais pas des liaisons Pi car il n'y a pas d'orbitales p. La forme ionique de l'hydrogène atomique est l'ion hydrogène, qui n'a pas son électron. C'est un cation. Le symbole chimique de l'ion hydrogène est H+.
Préparation de l'hydrogène atomique
Il existe deux méthodes pour obtenir l'hydrogène atomique.
Réactions de dissociation thermique
- Ici, l'hydrogène moléculaire (H2) est chauffé à une température très élevée pour environ 500 ° C. Puis les molécules d'hydrogène se dissocient en hydrogène atomique. Cependant, c'est toujours une approche théorique.
Méthode de décharge électrique
- Cela se fait à 0.1 - 1.00 mmHg de pression dans un tube à décharge électrique. Le système est utilisé à l'aide d'hydrogène moléculaire (hydrogène gaz). Les électrodes en tungstène sont utilisées pour préparer l'arche électrique.
Qu'est-ce que l'hydrogène naissant?
Le terme hydrogène naissant est utilisé pour appeler l'hydrogène libéré lors d'une réaction chimique. Il est considéré que l'hydrogène libéré lors de la progression d'une réaction chimique est initialement à l'état atomique; Il est ensuite combiné pour former l'hydrogène moléculaire et libéré sous forme d'hydrogène gazeux (ou bien, cet hydrogène atomique réagira avec certains autres ions disponibles). Par exemple,
Zn + 2hcl → Zncl2 + 2 [H]
Quelles sont les similitudes entre l'hydrogène atomique et l'hydrogène naissant?
- Les deux sont des états atomiques isolés d'hydrogène.
- Les deux espèces sont très réactives et énergiques.
Quelle est la différence entre l'hydrogène atomique et l'hydrogène naissant?
Hydrogène atomique vs hydrogène naissant | |
| L'hydrogène atomique fait référence à l'hydrogène obtenu par dissociation de l'hydrogène moléculaire. | L'hydrogène naissant fait référence à l'hydrogène libéré lors d'une réaction chimique. |
| Application | |
| L'hydrogène atomique est une forme isolée d'hydrogène, qui est très réactive et énergique; C'est un élément majeur de l'univers. | L'hydrogène naissant est l'état atomique initial de l'hydrogène qui est formé lors d'une réaction chimique. |
Résumé - Hydrogène atomique vs hydrogène naissant
L'hydrogène atomique est la forme isolée de l'élément chimique, l'hydrogène. L'hydrogène naissant est également une forme isolée d'hydrogène. Mais ces deux termes sont différents dans leur application. La principale différence entre l'hydrogène atomique et l'hydrogène naissant est qu'un atome d'hydrogène ou d'hydrogène obtenu par dissociation de l'hydrogène moléculaire est connu sous le nom d'hydrogène atomique alors que le terme hydrogène naissant est utilisé pour appeler l'hydrogène libéré lors d'une réaction chimique.
Référence:
1. «ATOMIC HYDROGEN» CITY. Disponible ici.
2. «Atome d'hydrogène.»Wikipedia, Wikimedia Foundation, 18 février. 2018, disponible ici.
3. "Hydrogène.»Wikipedia, Wikimedia Foundation, 18 février. 2018, disponible ici.
Image gracieuseté:
1.”Blausen 0526 Hydrogène-1Atom” par Bruceblaus - Propre travaux (CC par 3.0) via Commons Wikimedia


