Différence entre ampholyte et amphotérique
Le différence clé entre ampholyte et amphotérique est que Le terme amphotérique signifie la capacité d'une molécule à agir comme un acide ou une base alors qu'un ampholyte est une molécule, qui est amphotérique.
Nous rencontrons des molécules, que nous classons comme de base, acide ou neutre. Les solutions de base montrent des valeurs de pH supérieures à 7 et les solutions acides montrent des valeurs de pH, qui sont inférieures à 7. Les solutions ayant une valeur de pH 7 sont les solutions neutres. Il existe certaines molécules, qui diffèrent de cette catégorisation normale. Les ampholytes sont une telle molécule. Ils ont à la fois une nature chimique acide et de base.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ampholyte
3. Qu'est-ce que l'amphotérique
4. Comparaison côte à côte - ampholyte vs amphotérique sous forme tabulaire
5. Résumé
Qu'est-ce que l'ampholyte?
Un ampholyte est une molécule ayant des groupes de base et acides. L'exemple commun le meilleur et le plus largement survenant pour l'ampholyte est les acides aminés. Nous savons que tous les acides aminés ont -cooh, -nh2 des groupes et un -h se sont liés à un carbone. Le groupe carboxylique (-COOH) agit comme le groupe acide dans l'acide aminé et l'amine (-nh2) Le groupe agit comme le groupe de base. Autre que ceux-ci, il y a un groupe -r dans chaque acide aminé. Le groupe R diffère d'un acide aminé à un autre. L'acide aminé le plus simple avec le groupe R étant H est la glycine.
Cependant, le groupe R dans certains acides aminés contient des groupes carboxyliques ou des groupes d'amine supplémentaires. Par exemple, la lysine, l'histidine et l'arginine sont des acides aminés ayant des groupes d'amine supplémentaires. Et les acides aspartiques, les acides glutamiques contiennent des groupes carboxyliques supplémentaires. De plus, certains d'entre eux contiennent des groupes -OH, qui peuvent agir comme une base ou un acide dans certaines circonstances (tyrosine). En raison des groupes acides et de base, ils ont généralement au moins deux valeurs de PKA (s'il y a plus d'un -nh2 groupe de groupe ou -coooh, alors il y aura plus de deux valeurs PKA). Par conséquent, les courbes de titrage des ampholytes sont complexes que les courbes de titrage normales.
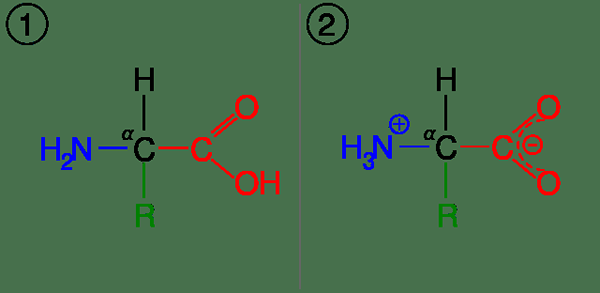
Figure 01: un acide aminé dans ses (1) formes non ionisées et (2) zwitterionic
Occurrence
Dans divers systèmes, les ampholytes se produisent sous diverses formes chargées en fonction du pH. Par exemple, dans une solution acide, le groupe amine des acides aminés se produira dans la charge positivement chargée, et le groupe carboxyle existera comme -cooh. Dans une solution de pH de base, le groupe carboxyle existera sous forme d'anion carboxylate (-coo-), et le groupe amino sera présent comme -nh2.
Dans les corps humains, le pH est proche de 7.4. Par conséquent, dans ce pH, les acides aminés sont présents sous forme de zwitterions. Ici, le groupe amino subit une protonation et a une charge positive, tandis que le groupe carboxyle a une charge négative. Par conséquent, la charge nette de la molécule est nul. À ce stade, la molécule atteint son point isoélectrique.
Qu'est-ce que l'amphotérique?
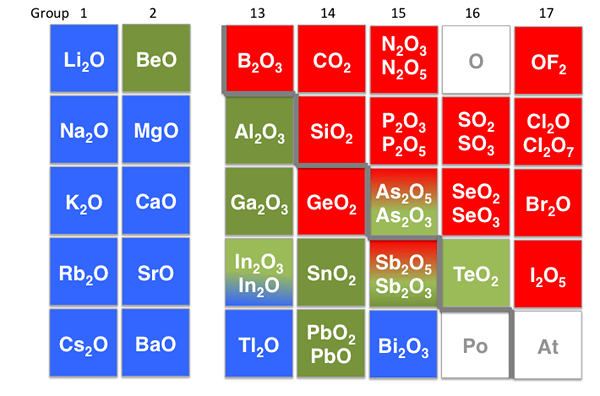
Le terme amphotérique signifie la capacité d'une molécule, d'un ion ou de tout autre composé complexe à agir comme une base et un acide. Il existe des molécules, qui ont les deux propriétés dans certaines circonstances. De plus, il y a des oxydes métalliques et des hydroxydes, qui sont amphotériques.
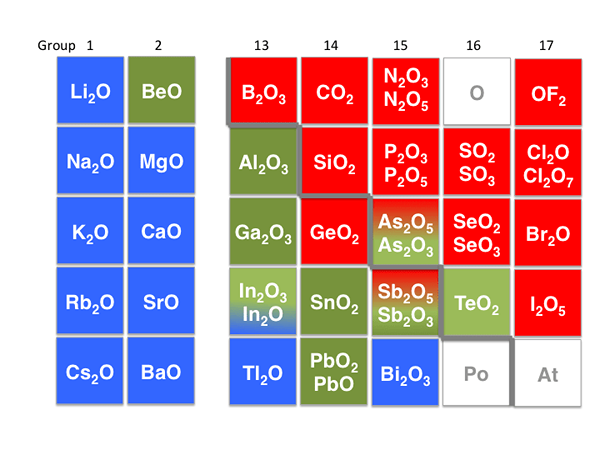
Figure 02: Composés amphotériques
Par exemple, l'oxyde de zinc (ZnO), l'oxyde d'aluminium (AL2O3), hydroxyde d'aluminium (AL (OH)3), et les oxydes de plomb sont amphotériques. Dans les médiums acides, ils agissent comme des bases et dans les médiums de base, ils agissent comme des acides. La molécule amphotérique la plus courante et la plus connue est les acides aminés, que nous pouvons observer dans tous les systèmes biologiques.
Quelle est la différence entre l'ampholyte et l'amphotérique?
Un ampholyte est une molécule ayant des groupes à la fois basiques et acides et le terme amphotérique signifie la capacité d'une molécule, d'un ion ou de tout autre composé complexe à agir comme une base et un acide. La principale différence entre ampholyte et amphotérique est que le terme amphotérique signifie la capacité d'une molécule à agir comme un acide ou une base alors qu'un ampholyte est une molécule qui est amphotérique.
De plus, l'oxyde de zinc, l'oxyde d'aluminium, l'hydroxyde d'aluminium et les oxydes de plomb sont amphotériques, qui ont des comportements différents dans les solutions acides et de base. Cependant, ce ne sont pas des ampholytes car ils n'ont pas de groupes acides et de base dans ces molécules. Quoi qu'il en soit, l'acide aminé est un ampholyte, qui a des groupes acides et de base présents dans une molécule. Par conséquent, c'est aussi amphotérique.

Résumé - Ampholyte vs amphotérique
Amphotérique signifie la capacité d'une molécule à agir comme un acide ou une base. Les ampholytes sont des molécules qui sont amphotériques. Par conséquent, les ampholytes ont des groupes acides et de base. Par conséquent, la principale différence entre ampholyte et amphotérique est que le terme amphotérique signifie la capacité d'une molécule à agir comme un acide ou une base alors qu'un ampholyte est une molécule qui est amphotérique.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition et exemples amphotériques.”Thoughtco, Jun. 22, 2018. Disponible ici
2. LibreTexts. «Amphotérique.”Chemistry LibreTexts, National Science Foundation, 20 février. 2017. Disponible ici
Image gracieuseté:
1.«Amios Acid Zwitterions» par Timvickersvector (CC par 3.0) via Commons Wikimedia
2.«Amphotérique» par TEM5PSU - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


