Différence entre l'ammoniac et le nitrate d'ammonium
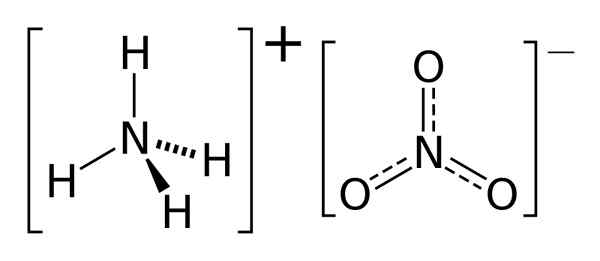
Le différence clé entre l'ammoniac et le nitrate d'ammonium est que L'ammoniac est un composé gazeux tandis que le nitrate d'ammonium est un composé solide à température ambiante et à la pression.
L'ammoniac et le nitrate d'ammonium sont des composés contenant de l'azote. Cependant, il existe des différences entre l'ammoniac et le nitrate d'ammonium dans leur structure chimique, leur apparence et leurs propriétés. Nous discuterons des principales différences entre l'ammoniac et le nitrate d'ammonium dans cet article.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ammoniac
3. Qu'est-ce que le nitrate d'ammonium
4. Comparaison côte à côte - Ammoniac vs nitrate d'ammonium sous forme tabulaire
5. Résumé
Qu'est-ce que l'ammoniac?
L'ammoniac est un composé chimique inorganique ayant la formule chimique NH3. Il existe à l'état gazeux à température ambiante et à la pression. Ainsi, il est incolore et a une odeur piquante et irritante. De plus, il est généralement considéré comme un déchet azoté, principalement parmi les organismes aquatiques. De même, c'est un composé alcalin. Le nom IUPAC du composé est azane.
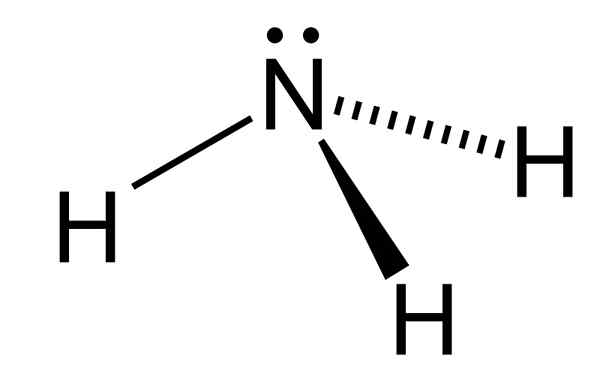
Figure 01: Structure chimique de la molécule d'ammoniac
Certains autres faits chimiques sur ce gaz sont les suivants:
- La masse molaire est de 17.031 g / mol.
- C'est un gaz incolore avec une odeur piquante.
- Le point de fusion est -77.73 ° C.
- Le point d'ébullition est -33.34 ° C.
- La géométrie moléculaire est un trigonal
- C'est un gaz inflammable.
Lorsque l'on considère la géométrie de la molécule d'ammoniac, il a trois liaisons N-H avec une paire d'électrons solitaires sur les atomes d'azote, disposée en géométrie pyramidale trigonale. En raison de la présence si cette paire d'électrons solitaires, l'angle de liaison de la molécule est de 107 °. Puisqu'il y a des liaisons N-H, la molécule peut former des liaisons hydrogène. De plus, l'ébullition de l'ammoniac aqueux émet facilement du gaz d'ammoniac en raison de son faible point d'ébullition.
Qu'est-ce que le nitrate d'ammonium?
Le nitrate d'ammonium est un composé inorganique ayant la formule chimique NH4NON3. C'est un sel contenant un cation ammonium et un anion nitrate. Le nitrate d'ammonium apparaît comme un solide blanc à température ambiante et se dissout facilement dans l'eau. De plus, il se produit comme un minéral naturel de nature.

Figure 02: Structure chimique du nitrate d'ammonium
Certains faits chimiques sur ce composé sont les suivants:
- La masse molaire est de 80.043 g / mol.
- Apparaît comme un solide blanc ou gris.
- Le point de fusion est 169.6 ° C.
- Au-dessus de 210 ° C, il se décompose.
- La structure cristalline du composé est trigonale.
En outre, l'utilisation majeure de ce composé est dans l'agriculture comme elle est très utile en tant qu'engrais à haute azote. En dehors de cela, nous pouvons l'utiliser pour produire des mélanges explosifs à des fins d'extraction et de carrière. De plus, comme la dissolution de ce composé dans l'eau est très endothermique, elle est également utile dans certains packs froids instantanés.
Quelle est la différence entre l'ammoniac et le nitrate d'ammonium?
L'ammoniac est un composé chimique inorganique ayant la formule chimique NH3 tandis que le nitrate d'ammonium est un composé inorganique ayant la formule chimique NH4NON3. La principale différence entre l'ammoniac et le nitrate d'ammonium est que l'ammoniac est un composé gazeux tandis que le nitrate d'ammonium est un composé solide à température ambiante et à la pression. En dehors de cela, il y a une différence entre l'ammoniac et le nitrate d'ammonium dans leur structure. C'est-à-dire; L'ammoniac est une molécule pyramidale trigonale tandis que le nitrate d'ammonium est un composé ionique ayant la structure cristalline trigonale. Lorsque vous envisagez les applications, l'ammoniac est utile en tant qu'engrais, un précurseur des composés azotés, en tant que nettoyeur de ménage, dans l'industrie de la fermentation, etc. tandis que le nitrate d'ammonium est utile comme engrais et comme composant dans des mélanges explosifs.
L'infographie ci-dessous sur la différence entre l'ammoniac et le nitrate d'ammonium montre plus de différences dans la forme tabulaire.
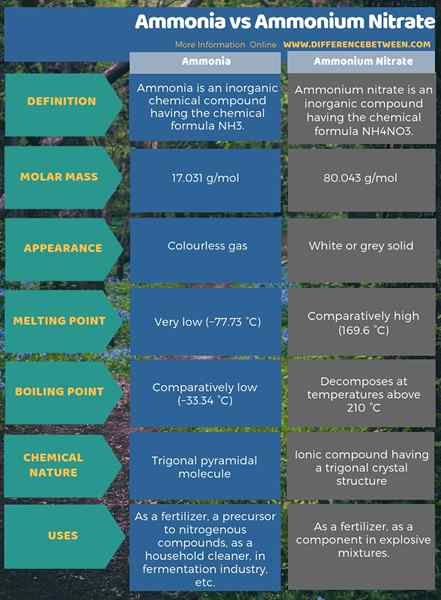
Résumé - Ammoniac vs nitrate d'ammonium
L'ammoniac et le nitrate d'ammonium sont des composés azotés qui contiennent des atomes d'azote dans leur structure chimique. En résumé, la principale différence entre l'ammoniac et le nitrate d'ammonium est que l'ammoniac est un composé gazeux tandis que le nitrate d'ammonium est un composé solide à température ambiante et à la pression.
Référence:
1. "Nitrate d'ammonium.»Wikipedia, Wikimedia Foundation, 21 octobre. 2018. Disponible ici
2. "Ammoniac.»Wikipedia, Wikimedia Foundation, 26 octobre. 2018. Disponible ici
Image gracieuseté:
1.«Ammoniac-2d» par Radio89 - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Ammonium-nitrate-2d» par Mikayé (domaine public) via Commons Wikimedia


