Différence entre le nitrate et le nitrite
Le différence clé entre le nitrate et le nitrite est que Le nitrate contient trois atomes d'oxygène liés à un atome d'azote tandis que le nitrite contient deux atomes d'oxygène liés à un atome d'azote.
Le nitrate et le nitrite sont des anions inorganiques constitués d'atomes d'azote et d'oxygène. Ces deux anions ont une charge électrique -1. Ils se produisent principalement comme l'anion des composés de sel. Il existe certaines différences entre le nitrate et le nitrite; Nous discuterons de ces différences dans cet article.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le nitrate
3. Qu'est-ce que le nitrite
4. Comparaison côte à côte - nitrate vs nitrite sous forme tabulaire
5. Résumé
Qu'est-ce que le nitrate??
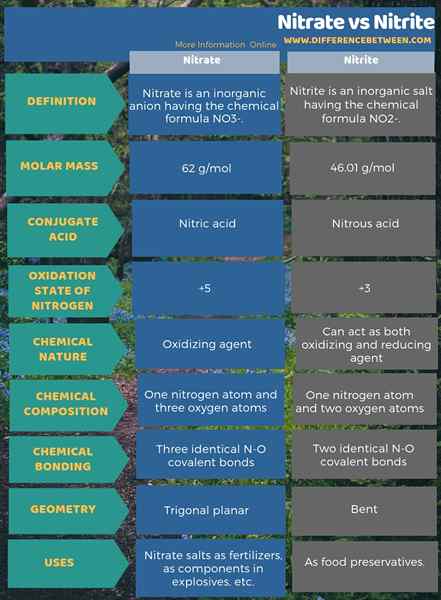
Le nitrate est un anion inorganique ayant la formule chimique no3-. Il s'agit d'un anion polyatomique qui a 4 atomes; un atome d'azote et trois atomes d'oxygène. L'anion a -1 charge globale. La masse molaire de cet anion est de 62 g / mol. De plus, cet anion est dérivé de son acide conjugué; acide nitrique ou HNO3. En d'autres termes, le nitrate est la base conjuguée de l'acide nitrique.
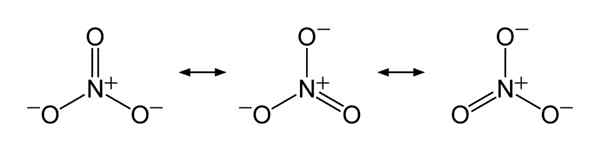
En bref, l'ion nitrate a un atome d'azote au centre qui se lie à trois atomes d'oxygène via une liaison chimique covalente. Lorsque l'on considère la structure chimique de cet anion, il a trois liaisons N-O identiques (selon les structures de résonance de l'anion). Par conséquent, la géométrie de la molécule est planaire trigonale. Chaque atome d'oxygène porte un - 2⁄3 charge, ce qui donne la charge globale de l'anion comme -1.

Figure 01: Structures de résonance de l'ion nitrate
À la pression et à la température standard, presque tous les composés de sel contenant cet anion se dissout dans l'eau. Nous pouvons trouver des sels de nitrate naturels sur Terre comme des dépôts; dépôts de nitratine. Il contient principalement du nitrate de sodium. De plus, les bactéries nitrifiantes peuvent produire des ions de nitrate. L'une des principales utilisations des sels de nitrate est la production d'engrais. De plus, il est utile en tant qu'agent oxydant dans les explosifs.
Qu'est-ce que le nitrite?
Le nitrite est un sel inorganique ayant la formule chimique no2-. Cet anion est un anion symétrique, et il a un atome d'azote lié à deux atomes d'oxygène avec deux liaisons chimiques covalentes N-O identiques. Par conséquent, l'atome d'azote est au centre de la molécule. L'anion a -1 charge globale.
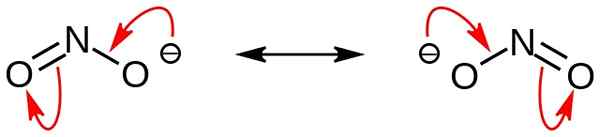
Figure 02: Structures de résonance de l'ion nitrite
La masse molaire de l'anion est 46.01 g / mol. De plus, cet anion est dérivé de l'acide nitreux ou HNO2. Par conséquent, c'est la base conjuguée de l'acide nitreux. Par conséquent, nous pouvons produire des sels de nitrite industriellement en passant par les fumées nitreuses dans une solution aqueuse d'hydroxyde de sodium. De plus, cela produit du nitrite de sodium que nous pouvons purifier par recristallisation. De plus, les sels de nitrite tels que le nitrite de sodium sont utiles dans la conservation des aliments car il peut empêcher les aliments de la croissance microbienne.
Quelle est la différence entre le nitrate et le nitrite?
Le nitrate est un anion inorganique ayant la formule chimique no3- tandis que le nitrite est un sel inorganique ayant la formule chimique no2-. Par conséquent, la principale différence entre le nitrate et le nitrite réside sur la composition chimique des deux anions. C'est-à-dire; La principale différence entre le nitrate et le nitrite est que le nitrate contient trois atomes d'oxygène liés à un atome d'azote tandis que le nitrite contient deux atomes d'oxygène liés à un atome d'azote. De plus, l'ion nitrate est dérivé de son acide conjugué; L'acide nitrique, tandis que l'ion nitrite est dérivé de l'acide nitreux. Comme autre différence importante entre les ions nitrate et nitrite, nous pouvons dire que le nitrate est un agent oxydant car il peut subir la seule réduction tandis que le nitrite peut agir à la fois comme un agent oxydant et réducteur.
Résumé - Nitrate vs nitrite
Le nitrate et le nitrite sont des anions azotés qui se produisent principalement sous forme de composés de sel. La principale différence entre le nitrate et le nitrite est que le nitrate contient trois atomes d'oxygène liés à un atome d'azote tandis que le nitrite contient deux atomes d'oxygène liés à un atome d'azote.
Référence:
1. "Nitrate.»Wikipedia, Wikimedia Foundation, 6 octobre. 2018. Disponible ici
2. "Nitrite.»Wikipedia, Wikimedia Foundation, 1er novembre. 2018. Disponible ici
Image gracieuseté:
1.«Nitrate-ion-Resonance-2d» par Ben Mills - Propre travaux, (domaine public) via Commons Wikimedia
2.«Nitrite-ion-canonical-structures» par Nothingserious - propre travail, (domaine public) via Commons Wikimedia


