Différence entre l'ammoniac et l'hydroxyde d'ammonium
Le différence clé entre l'ammoniac et l'hydroxyde d'ammonium est que L'ammoniac se produit comme un gaz tandis que l'hydroxyde d'ammonium se produit sous forme de liquide à température ambiante.
L'ammoniac et l'hydroxyde d'ammonium ont de nombreuses utilisations pour nous. Nous savons tous que l'ammoniac est un gaz piquant avec une formule chimique NH3. Quand il entre en contact avec l'eau, ce que nous obtenons, c'est l'hydroxyde d'ammonium. Par conséquent, nous nommons parfois l'hydroxyde d'ammonium comme «solution d'ammoniac».
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ammoniac
3. Qu'est-ce que l'hydroxyde d'ammonium
4. Comparaison côte à côte - Ammoniac vs hydroxyde d'ammonium sous forme tabulaire
5. Résumé
Qu'est-ce que l'ammoniac?
L'ammoniac est une substance gazeuse ayant la formule chimique NH3. C'est un composé inorganique et c'est aussi l'hydrate de pnictogène le plus simple. C'est un gaz incolore mais a une odeur piquante et irritante. De plus, le nom IUPAC de l'ammoniac est azane.
Certains faits chimiques importants sur cette substance sont les suivants:
- La formule chimique est NH3
- La masse molaire est de 17.03 g / mol.
- Apparaît comme un gaz incolore
- Le point de fusion est -77.73 ° C
- Le point d'ébullition est -33.34 ° C
Lorsque vous envisagez l'occurrence de ce composé, il se produit naturellement mais en quantités de trace. C'est un produit de matière azotée et légume. Parfois, nous pouvons également trouver de l'ammoniac dans l'eau de pluie. À l'intérieur de notre corps, les reins sécrètent de l'ammoniac pour neutraliser l'excès d'acide.

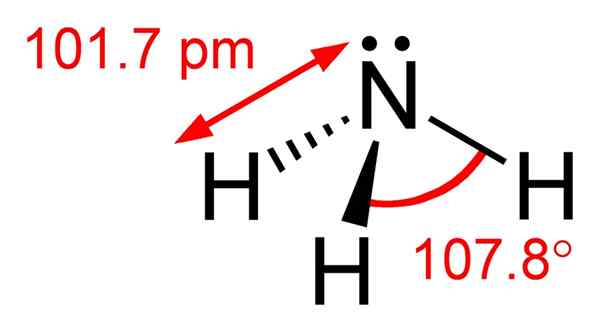
Figure 01: Structure chimique de la molécule d'ammoniac
Dans la structure chimique de la molécule d'ammoniac, il a un atome d'azote lié à trois atomes d'hydrogène. Puisqu'il y a cinq électrons dans la coque d'électrons la plus externe d'azote, il y a une paire d'électrons solitaires sur l'atome d'azote de la molécule d'ammoniac. Par conséquent, la géométrie de la molécule d'ammoniac est pyramidale trigonale. De plus, nous pouvons facilement liquéfier ce composé. En effet.
Qu'est-ce que l'hydroxyde d'ammonium?
L'hydroxyde d'ammonium est une substance liquide ayant la formule chimique NH4OH. C'est aussi un composé inorganique. Nous pouvons l'appeler comme une solution d'ammoniac car ce composé se forme lorsque le gaz de l'ammoniac réagit avec l'eau. Par conséquent, nous pouvons le désigner comme NH3(aq). Bien que le nom de l'hydroxyde d'ammonium implique l'existence d'un composé alcalin, il est en fait impossible d'isoler l'hydroxyde d'ammonium composé chimique.
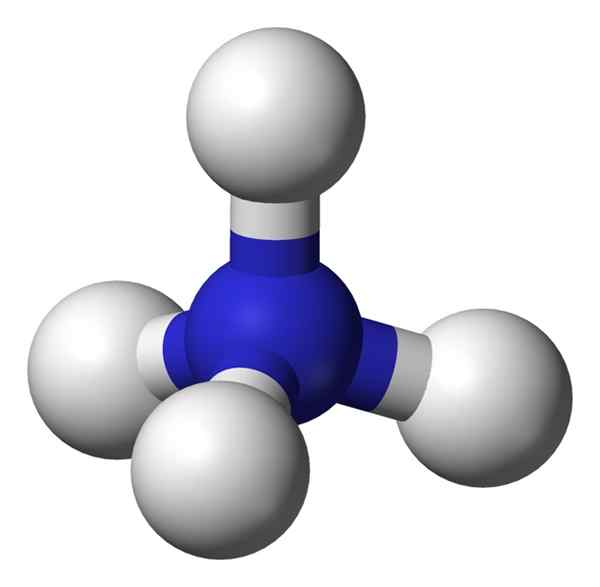
Figure 02: modèle de balle et de bâton pour l'ion ammonium
Certains faits chimiques importants sur ce composé sont les suivants:
- La formule chimique est NH4OH
- La masse molaire est 35.04 g / mol.
- Apparaît comme un liquide incolore.
- Il a une odeur hautement piquante.
- Le point de fusion est -57.5 ° C
- Le point d'ébullition est 37.7 ° C
Lorsque vous envisagez les applications de ce liquide, il est utile en tant que nettoyeur de ménage, en tant que précurseur d'alkyl amine, à des fins de traitement de l'eau, et de nombreuses autres applications sont là.
La réaction de la formation de ce composé est la suivante:
NH3 + H2O -> NH4+ + OH-
Quelle est la différence entre l'ammoniac et l'hydroxyde d'ammonium?
L'ammoniac est une substance gazeuse ayant la formule chimique NH3 tandis que l'hydroxyde d'ammonium est une substance liquide ayant la formule chimique NH4OH. Par conséquent, la principale différence entre l'ammoniac et l'hydroxyde d'ammonium existe dans leurs états physiques. C'est-à-dire que la différence entre l'ammoniac et l'hydroxyde d'ammonium est que l'ammoniac se produit comme un gaz tandis que l'hydroxyde d'ammonium se produit sous forme de liquide à température ambiante. Étant donné que l'hydroxyde d'ammonium se forme lorsque le gaz d'ammoniac dissous dans l'eau, nous appelons ce composé comme une solution d'ammoniac ou de l'ammoniac liquide également. De plus, une autre différence entre l'ammoniac et l'hydroxyde d'ammonium est que l'ammoniac est anhydre, tandis que l'hydroxyde d'ammonium est hydrautique.

Résumé - Ammoniac vs hydroxyde d'ammonium
L'hydroxyde d'ammonium se forme à partir de la dissolution du gaz d'ammoniac dans l'eau. Par conséquent, l'hydroxyde d'ammonium est en fait une solution aqueuse d'ammoniac. Cependant, la principale différence entre l'ammoniac et l'hydroxyde d'ammonium est que l'ammoniac se produit comme un gaz tandis que l'hydroxyde d'ammonium se produit sous forme de liquide à température ambiante.
Référence:
1. "Ammoniac.»Wikipedia, Wikimedia Foundation, 16 octobre. 2018. Disponible ici
2. "Une solution d'ammoniaque.»Wikipedia, Wikimedia Foundation, 17 octobre. 2018. Disponible ici
Image gracieuseté:
1.Ammoniac-Dimensions-from-Greenwood & Earnshaw-2d »par Ben Mills - Propre travaux, (domaine public) via Commons Wikimedia
2.«Ammonium-3D-balls» (domaine public) via Commons Wikimedia


