Différence entre l'acyl et l'alkyl
Différence clé - acyl vs alkyl
Presque toutes les molécules organiques dans la nature ont des groupes fonctionnels dans leur structure, qui détermine les propriétés chimiques et physiques de ces molécules. Les termes alkyl et acyl se réfèrent aux fractions (une partie) de grandes molécules. L'alkyle et l'acyle peuvent agir comme les groupes fonctionnels de la molécule principale. Ces deux groupes contiennent des atomes de carbone et d'hydrogène. La principale différence entre les groupes alkyl et acyle est que Le groupe acyle a un atome d'oxygène attaché avec une double liaison à l'atome de carbone alors que Le groupe alkyle n'a pas d'atome d'oxygène attaché à ses atomes de carbone.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acyle
3. Qu'est-ce que l'alkyle
4. Comparaison côte à côte - acyl vs alkyl sous forme tabulaire
5. Résumé
Qu'est-ce que le groupe acyle?
Le groupe acyl est un groupe fonctionnel présent dans certaines molécules organiques. Il est composé d'un atome de carbone attaché à un atome d'oxygène à double liaison et à un groupe alkyle. Le groupe acyl peut être facilement reconnu en raison de la présence de c = o double liaison. Il y a un espace vacant pour qu'un autre atome ou un groupe s'y attache. Le groupe acyle est formé par l'élimination d'un groupe hydroxyle d'un oxoacide tel que l'acide carboxylique. Normalement, les groupes d'acyle se trouvent dans les esters, les aldéhydes, les cétones, les chlorures acides, etc.
Le symbole général du groupe acyl est donné comme RCO-. Le carbocation fabriqué à partir d'un groupe acyle est RCO+. Ici, le groupe R est attaché à l'atome de carbone avec une seule liaison tandis que l'atome d'oxygène est attaché à l'atome de carbone avec une double liaison. Un exemple courant pour une molécule contenant un groupe acyle est l'acyle chlorures où le groupe acyle est attaché à un atome de chlorure. Le groupe R peut être un groupe alkyle ou un anneau aromatique.
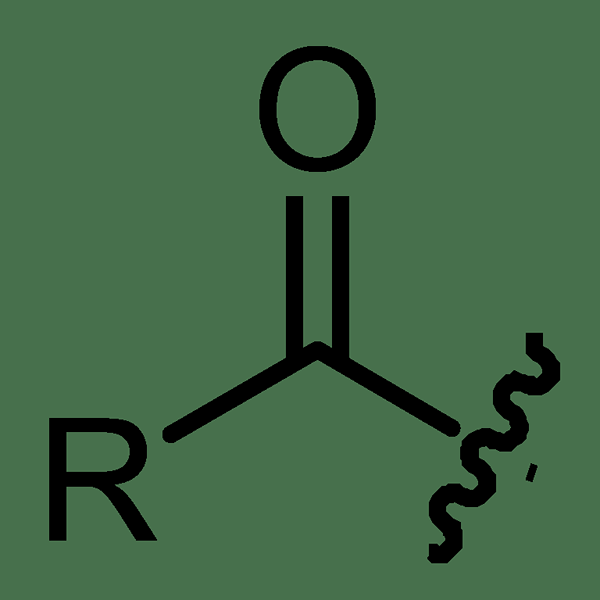
Figure 01: groupe acyle
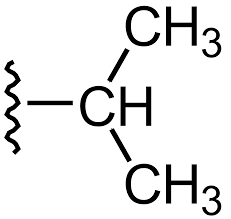
Qu'est-ce que le groupe alkyle?
L'alkyle peut être défini comme un radical d'hydrocarbure. Le groupe alkyle est également un groupe fonctionnel. Il n'est composé que d'atomes de carbone et d'hydrogène. Contrairement au groupe acyle, il n'y a pas d'atomes d'oxygène dans le groupe alkyle. Le groupe alkyle est dérivé d'un alcane. Un atome d'hydrogène est retiré de l'alcane, il y a donc un espace vacant pour qu'il s'attache à un autre atome ou molécule. La formule générale peut être donnée comme cnH2n + 1.
Les groupes alkyles peuvent également être substitués aux anneaux aromatiques. Les groupes alkyle peuvent être regroupés en quelques types selon le carbone qui a l'espace vacant tel que le primaire, le secondaire et le tertiaire. Le nom du groupe alkyle est dérivé du nom de l'alcane correspondant. Certains des groupes alkyles communs comprennent le méthyle, l'éthyle, le propyl, etc.

Figure 02: groupe alkyle
Quelle est la différence entre l'acyl et l'alkyl?
Acyl vs alkyle | |
| Le groupe acyl est composé d'un atome d'oxygène. | Le groupe alkyle n'a pas d'atome d'oxygène. |
| Origine | |
| Le groupe acyl est dérivé des oxoacides. | Le groupe alkyle est dérivé des alcanes. |
| Obligations | |
| Le groupe acyl a une double liaison essentiellement entre l'atome de carbone et l'atome d'oxygène. | Le groupe alkyle n'a pas une telle double liaison. |
| Hybridation | |
| L'atome de carbone en groupe acyle est SP2 hybridé | L'atome de carbone en groupe alkyle est SP3 hybridé. |
| Identification | |
| Les composés contenant des groupes d'acyle provoquent une acidité dans l'eau lors du test des solutions de pH. | Les composés contenant des groupes alkyle ne provoquent pas d'acidité lorsque les solutions de pH sont testées. |
Résumé - groupe acyl vs alkyle
Les groupes acyle et alkyle agissent comme des groupes fonctionnels lorsqu'ils sont attachés à une chaîne de carbone. La principale différence entre le groupe acyl et alkyle est que le groupe acyl a un atome d'oxygène attaché à l'atome de carbone avec une double liaison tandis que le groupe alkyle n'a pas d'atomes d'oxygène.
Les références:
1.Kennepohli, D., 2016. LibreTexts. [En ligne] Disponible ici [consulté 30 05 2017].
2. Marie, une., n.d. Thoughtco… [en ligne] disponible ici [consulté 30 05 2017].
Image gracieuseté:
1. «Group acyl» (domaine public) via Commons Wikimedia
2. «Group isopropyl» par Su-NO-G - propre travail. Fabriqué avec Coreldraw, pas avec ChemDraw. (Domaine public) via Commons Wikimedia


