Différence entre l'acide acétique et l'acétate
Différence clé - acide acétique vs acétate
La principale différence entre l'acide acétique et l'acétate est que L'acide acétique est un composé neutre tandis que l'acétate est un anion ayant une charge électrique négative nette.
L'acide acétique est un composé organique qui aide à fabriquer du vinaigre tandis que l'ion acétate est la base conjuguée de l'acide acétique. Plus important encore, la formation de l'ion acétate se produit par l'élimination de l'atome d'hydrogène dans le groupe carboxylique de l'acide acétique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide acétique
3. Qu'est-ce que l'acétate
4. Comparaison côte à côte - acide acétique vs acétate sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide acétique?
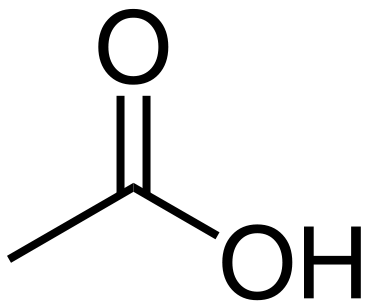
L'acide acétique est un composé organique ayant la formule chimique Ch3COOH. La masse molaire de ce composé est de 60 g / mol tandis que le nom IUPAC de ce composé est Acide éthanoique. De plus, à température ambiante, l'acide acétique est un liquide incolore avec un goût aigre. L'acide acétique est classé comme un acide carboxylique à la suite de la présence d'un groupe d'acide carboxylique (-COOH).

Figure 1: molécule d'acide acétique
L'acide acétique glaciaire est la forme concentrée d'acide acétique. De plus, l'acide acétique a une odeur piquante, qui est similaire à l'odeur du vinaigre et un goût aigre caractéristique également. C'est aussi un acide faible car il se dissocie partiellement en solution aqueuse, libérant un anion acétate et un proton. L'acide acétique a un proton dissociable par molécule. Cependant, l'acide glaciaire est un irritant très corrosif.
L'acide acétique est un acide carboxylique simple; En fait, c'est le deuxième acide carboxylique le plus simple. Dans l'état solide de l'acide acétique, les molécules forment des chaînes de molécules via une liaison hydrogène. Cependant, dans la phase de vapeur de l'acide acétique, il forme des dimères (deux molécules connectées les unes aux autres via des liaisons hydrogène). Étant donné que l'acide acétique liquide est un solvant protique polaire, il est miscible avec de nombreux solvants polaires et non polaires.
Qu'est-ce que l'acétate?
L'acétate est un anion formé à partir de l'élimination d'un atome d'hydrogène de l'acide acétique. Cet anion a une charge négative nette (la charge est -1 à la suite de la libération d'un proton). Ion acétate ne peut pas rester en tant que composé individuel en raison de sa charge, qui est très réactive. Ainsi, il existe principalement comme un sel d'un métal alcali. L'ion acétate est la base conjuguée de l'acide acétique, qui se forme par conséquent de la dissociation de l'acide acétique.
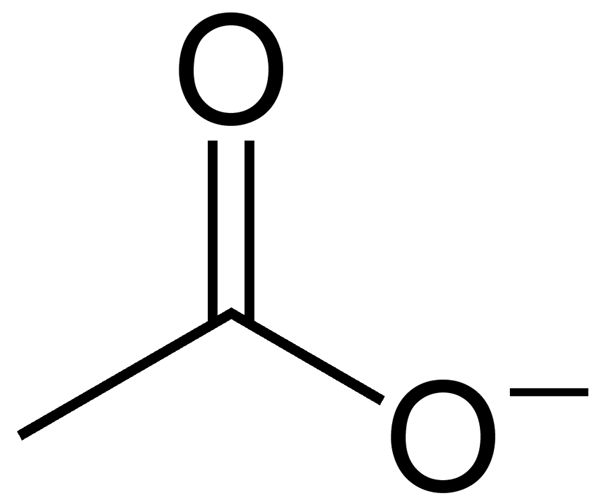
Figure 2: Anion acétate
La formule chimique de cet anion est C2H3O2- alors que Son nom IUPAC est éthanoate. De plus, la masse molaire d'acétate est de 59 g / mol. Plus précisément, à des valeurs de pH supérieures à 5.5, l'acide acétique existe sous forme d'anion acétate, libérant un proton spontanément. En effet, à un pH élevé, l'ion acétate est stable que l'acide acétique.
Quelle est la différence entre l'acide acétique et l'acétate?
Acide acétique vs acétate | |
| L'acide acétique est un composé organique ayant la formule chimique ch3COOH. | L'acétate est un anion formé à partir de l'élimination d'un atome d'hydrogène de l'acide acétique. |
| Masse molaire | |
| La masse molaire d'acide acétique est de 60 g / mol. | Mais la masse molaire d'acétate est de 59 g / mol. |
| Charge électrique | |
| L'acide acétique n'a pas de charge nette. | L'acétate a une charge négative. |
| Catégorie | |
| L'acide acétique est une molécule organique. | L'acétate est un anion organique. |
| pH | |
| Les molécules d'acide acétique sont stables à faible valeur de pH (environ pH 5). | L'ion acétate est stable à des valeurs de pH élevées (supérieures à pH 5.5). |
Résumé - acide acétique vs acétate
L'acide acétique est le deuxième acide carboxylique le plus simple. L'acétate, en revanche, est un anion dérivé de l'acide acétique. La principale différence entre l'acide acétique et l'acétate est que l'acide acétique est un composé neutre tandis que l'acétate est un anion ayant une charge électrique négative nette.
Référence:
1. "Acide acétique.»Wikipedia, 18 avril. 2018, disponible ici.
2. "Acide acétique.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
3. "Acétate.”Wikipedia, 10 avril. 2018, disponible ici.
Image gracieuseté:
1. «Acétique-acide-2d-squelettique» (domaine public) via les communes Wikimedia
2. «Acétate-anion-canonical-forme-2d-squelettique» (domaine public) via les communes Wikimedia


