Différence entre KD et KM
Différence clé - KD vs km
KD et KM sont des constantes d'équilibre. La principale différence entre Kd et Km est que KD est une constante thermodynamique alors que KM n'est pas une constante thermodynamique.
KD fait référence à la constante de dissociation tandis que KM est la constante de Michaelis. Ces deux constantes sont très importantes dans l'analyse quantitative des réactions enzymatiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que KD
3. Qu'est-ce que KM
4. Comparaison côte à côte - kd vs km sous forme tabulaire
5. Résumé
Qu'est-ce que KD?
KD est constant de dissociation. Il est également connu sous le nom constante de dissociation d'équilibre En raison de son utilisation dans les systèmes d'équilibre. La constante de dissociation est la constante d'équilibre des réactions où un grand composé est converti en petits composants réversiblement. Le processus de cette conversion est également connu sous le nom de dissociation. Une molécule ionique se dissocie toujours dans ses ions. Alors la constante de dissociation ou KD est une quantité exprimant la mesure dans laquelle une substance particulière en solution se dissocie en ions. Ainsi, cela est égal au produit des concentrations des ions respectifs divisés par la concentration de la molécule non dissociée.
Ab ↔ a + b
Dans la réaction générale ci-dessus, la constante de dissociation, KD peut être donné comme ci-dessous.
Kd = [a] [b] / [ab].
De plus, s'il existe une relation stoechiométrique, il faut inclure les coefficients stoechiométriques dans l'équation.
xab ↔ aa + bb
L'équation de la constante de dissociation, KD pour la réaction ci-dessus est la suivante:
Kd = [a]un[B]b / [UN B]X
Plus précisément, dans les applications biochimiques, KD aide à déterminer la quantité de produits donnés par une réaction chimique en présence d'une enzyme. Le KD d'une réaction enzymatique exprime l'affinité des récepteurs du ligand. En d'autres termes, il indique la capacité d'un substrat à quitter le récepteur d'une enzyme. D'un autre côté, il décrit à quel point un substrat se lie à l'enzyme.
Qu'est-ce que KM?
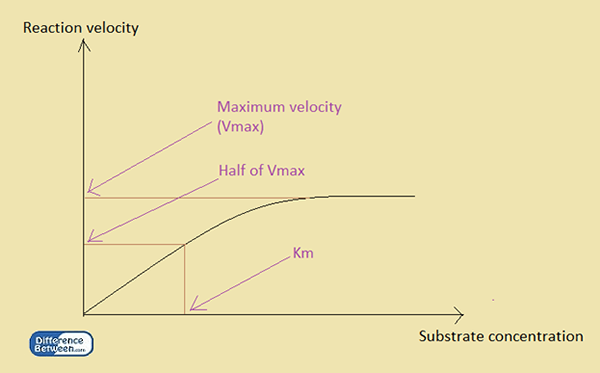
KM est la constante de Michaelis. Contrairement à KD, KM est une constante cinétique. Son application principale est dans la cinétique enzymatique, c'est-à-dire pour déterminer l'affinité d'un substrat pour se lier à une enzyme. La constante est exprimée en reliant la concentration du substrat à la vitesse de réaction en présence d'une enzyme. En conséquence, la constante de Michaelis ou le km est la concentration du substrat lorsque la vitesse de la réaction atteint la moitié de sa vitesse maximale.

Figure 1: La relation entre la vitesse de réaction et la concentration du substrat dans une réaction enzymatique.
Au cours d'une réaction entre l'enzyme (E) et le substrat (s), la formation de produits (P) est la suivante:
E + S ↔ E-S complexe ↔ e + p
Si les constantes d'équilibre de la réaction ci-dessus sont les suivantes, vous pouvez dériver KM de ces constantes.
Km = k-1 + K+2 / K+1
Détermination de KM selon le concept de Michael
Michaelis a développé une relation en utilisant la concentration de substrat, [s] et la vitesse de réaction maximale, vmax. La relation entre la concentration du substrat et le km d'une réaction enzymatique est la suivante:
v = vmax [s] / km + [s]
v est la vitesse à tout moment, tandis que [s] est la concentration de substrat à un moment particulier, et Vmax est la vitesse maximale de la réaction. KM est la constante de Michaelis pour l'enzyme dans la réaction. La valeur de la constante de Michaelis dépend de l'enzyme. Par conséquent, une petite valeur de km indique que l'enzyme est saturée d'une petite quantité de substrat. Alors le VMax est obtenu à une faible concentration de substrat. En revanche, une valeur de km élevée indique que l'enzyme nécessite une grande quantité de substrat pour devenir saturée.
Quelle est la différence entre KD et KM?
KD vs km | |
| KD est la constante de dissociation. | KM est la constante de Michaelis. |
| Nature | |
| KD est une constante thermodynamique. | Km est une constante cinétique. |
| Détails | |
| KD représente l'affinité d'un substrat vers une enzyme. | Km représente la relation entre la concentration du substrat et la vitesse de réaction. |
Résumé - KD vs km
KD et KM sont des constantes d'équilibre qui décrivent les propriétés des réactions enzymatiques. La principale différence entre Kd et Km est que KD est une constante thermodynamique alors que KM n'est pas une constante thermodynamique.
Référence:
1. «Michaelis-Minétique.»Wikipedia, Wikimedia Foundation, 10 avril. 2018, disponible ici.
2. «Introduction aux enzymes.»Concentration du substrat (introduction aux enzymes), disponible ici.
3. "Constante de dissociation.»Wikipedia, Wikimedia Foundation, 10 avril. 2018, disponible ici.


