Quelle est la différence entre la thymolphtaléine et la phénolphtaleine

Le Différence clé entre la thymolphtaléine et la phénolphtaleine est que le changement de couleur de la thymolphtaléine se produit de l'incolore au bleu, tandis que le changement de couleur de la phénolphtaléine se produit de la couleur incolore à la couleur rose lors de la modification des conditions de réaction de l'acide à basique.
Le thymolphthaleine et la phénolphtaleine sont deux indicateurs de pH différents qui sont très utiles dans les processus analytiques titrimétriques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le thymolphthaleine
3. Qu'est-ce que Phenolphthalein
4. Thymolphthaléine vs phénolphtaleine sous forme tabulaire
5. Résumé - Thymolphthalein vs phénolphtaleine
Qu'est-ce que le thymolphthaleine?
La thymolphthaléine est un type de colorant de phtalale qui est utile comme indicateur acide-base. La formule chimique de la thymolphthaleine est C28H30O4. C'est un indicateur de pH qui donne son changement de couleur sur les changements de pH du mélange réactionnel. La plage de pH de transition de cet indicateur est d'environ 9.3 - 10.5. Le thymolphthaleine est incolore en dessous de pH 9.3, alors qu'il apparaît en couleur bleue à des valeurs de pH supérieures à 10.5. De plus, le coefficient d'extinction molaire de la thymolphtaléine est de 38 000 m-1cm-1 à 595 nm pour l'anion indicateur de couleur bleue.
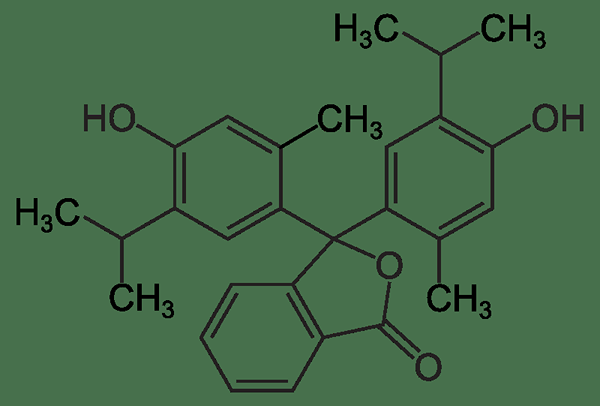
Figure 01: La structure chimique de l'indicateur de thymolphthaléine
La synthèse de la thymolphtaléine peut être réalisée en utilisant du thymol et de l'anhydride phtalique. Le produit de cette réaction de synthèse est une poudre blanche qui est également la forme disponible dans le commerce de thymolphtaleine. À des températures élevées, cette substance a tendance à se décomposer. De plus, cette substance est utilisée comme un laxatif et pour disparaître l'encre.
Qu'est-ce que Phenolphthalein?
La phénolphthaleine est un indicateur de pH qui est utile comme indicateur de titrage acide-base. Il s'agit d'un indicateur très courant que nous utilisons souvent dans nos processus de titrage de laboratoire. La formule chimique de cette substance est C20H14O4. Nous pouvons écrire ce terme simplement comme «hin» ou «phph». La couleur acide de la phénolphthaleine est incolore, tandis que la couleur de base de la phénolphthaleine est rose. La plage de pH pour que ce changement de couleur se produise est d'environ 8.3 - 10.0 pH.
De plus, l'indicateur de phénolphthaléine est légèrement soluble dans l'eau, et souvent, il se dissout dans les alcools. De cette façon, nous pouvons facilement les utiliser dans les titrages. La phénolphthaleine est un acide faible qui peut libérer des protons à la solution. La forme acide de la phénolphthaleine est non ionique, et elle est incolore. La forme déprotonée de phénolphthaleine est de couleur rose, et c'est une forme ionique. Si nous ajoutons une base au mélange réactionnel composé d'indicateur de phénolphtaléine, l'équilibre entre les formes ioniques et non ioniques a tendance à se déplacer vers l'état déprotoné car les protons sont retirés de la solution.

Figure 02: Couleur de base de Phenolphthalein
Concernant l'indicateur de synthèse de l'indicateur de phénolphtaléine, nous pouvons le produire à partir de la condensation de l'anhydride phtalique en présence de deux équivalents de phénol dans des conditions acides. De plus, cette réaction peut être catalysée à l'aide d'un mélange de chlorure de zinc et de chlorure de thionyle.
Quelle est la différence entre la thymolphtaléine et la phénolphtaleine?
Le thymolphthaleine et la phénolphtaleine sont deux indicateurs de pH différents qui sont très utiles dans les processus analytiques titrimétriques. La principale différence entre la thymolphtaléine et la phénolphtaléine est que le changement de couleur de la thymolphtaléine se produit de l'incolore au bleu, tandis que le changement de couleur de la phénolphtaléine se produit de la couleur incolore à la couleur rose lors du changement des conditions de réaction de l'acide à basique. De plus, la gamme active de pH de thymolphthaleine est 9.3 à 10.5 tandis que la plage de pH active de phénolphthalein est 8.3 à 10.0.
L'infographie ci-dessous présente les différences entre la thymolphtaléine et la phénolphtaleine sous forme tabulaire pour une comparaison côte à côte.
Résumé - Thymolphthalein vs phénolphtaleine
Le thymolphthaleine et la phénolphtaleine sont deux indicateurs de pH différents qui sont très utiles dans les processus analytiques titrimétriques. La principale différence entre la thymolphtaléine et la phénolphtaléine est que le changement de couleur de la thymolphtaléine se produit de l'incolore au bleu, tandis que le changement de couleur de la phénolphtaléine se produit de la couleur incolore à la couleur rose lors du changement des conditions de réaction de l'acide à basique.
Référence:
1. «Phénolphthalein." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «PHENOLPHTHALEIN-AT-PH-9» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia
2. «Thymolphthalein» par NeuroKer - Propre travaux (domaine public) via Commons Wikimedia


