Quelle est la différence entre les orbitales moléculaires Sigma et Pi
Le Différence clé entre Sigma et Pi Molecular Orbitals Est-ce que Sigma Molecular Orbital se forme à partir du chevauchement des orbitales atomiques dans une direction principale le long de l'axe internuclé.
Les orbitales moléculaires Sigma et Pi sont deux types d'orbitales moléculaires qui contribuent à la structure réelle d'un composé chimique. Les orbitales moléculaires sont responsables de la formation de liaisons simples et doubles ou triples, respectivement.
CONTENU
1. Aperçu et différence clé
2. Que sont les orbitales moléculaires
3. Quelles sont les orbitales moléculaires sigma
4. Quelles sont les orbitales moléculaires PI
5. Sigma vs orbitales moléculaires Pi sous forme tabulaire
6. Résumé - Sigma vs Pi Molecular Orbitals
Que sont les orbitales moléculaires?
Les atomes se réunissent pour former des molécules. Lorsque deux atomes se rapprochent pour former une molécule, les orbitales atomiques se chevauchent et se combinent pour devenir des orbitales moléculaires. Le nombre d'orbitales moléculaires nouvellement formées est égale au nombre d'orbitales atomiques combinés. De plus, l'orbital moléculaire entoure les deux noyaux des atomes, et les électrons peuvent se déplacer autour des deux noyaux. Semblable aux orbitales atomiques, les orbitales moléculaires contiennent au maximum 2 électrons, qui ont des tours opposés.
De plus, il existe deux types d'orbitales moléculaires comme orbitales moléculaires de liaison et les orbitales moléculaires anti-aléatoires. Les orbitales moléculaires de liaison contiennent des électrons à l'état fondamental, tandis que les orbitales moléculaires anti-admition ne contiennent aucun électrons à l'état fondamental. En outre, les électrons peuvent occuper des orbitales antibondantes si la molécule est dans un état excité.
Quelles sont les orbitales moléculaires sigma?
Les orbitales moléculaires sigma sont des types d'orbitales hybrides qui se forment à partir du chevauchement de deux orbitales atomiques de tête à tête le long de l'axe internucléaire. En règle générale, la première liaison covalente entre deux atomes est toujours une liaison sigma. Le chevauchement de deux orbitales atomiques dans l'axe inter-nucléaire forme une liaison covalente sigma. Dans une orbitale moléculaire sigma, la densité électronique au milieu de l'orbitale moléculaire est élevée si les deux atomes à partir desquels les orbitales atomiques se chevauchent sont identiques.

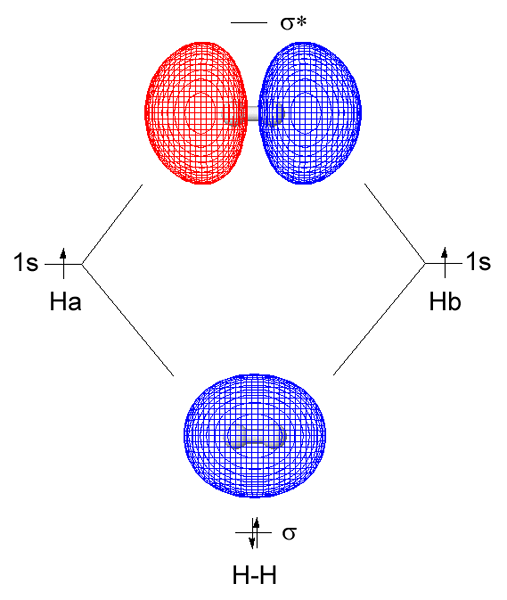
Figure 01: molécule d'hydrogène
Lorsque vous envisagez l'hydrogène comme exemple, les formes orbitales moléculaires Sigma à partir du chevauchement de deux orbitales atomiques 1S provenant de chaque atome d'hydrogène. Nous pouvons abréger cette liaison sigma comme σ. Ici, la densité d'électrons partagée se produit directement entre les atomes de liaison le long de l'axe de liaison. Cela fait une interaction plus stable entre deux atomes liés ainsi que les électrons de liaison par rapport à la stabilité des atomes séparés. En règle générale, une liaison sigma est la première liaison qui forme entre deux atomes.
Quelles sont les orbitales moléculaires PI?
Les orbitales moléculaires PI sont des types d'orbitales hybrides qui se forment à partir du chevauchement de deux orbitales atomiques dans la direction parallèle. Ici, la densité électronique de liaison se produit au-dessus et au-dessous de l'axe internucléaire. De plus, nous ne pouvons pas observer les électrons à l'axe de liaison. Ce type d'interaction entre deux atomes forme un arrangement plus stable que la stabilité des atomes libres séparés. Habituellement, les électrons ont tendance à occuper ce type d'orbitales moléculaires lorsque suffisamment d'électrons sont présents dans les atomes. Les orbitales moléculaires Pi se forment toujours en deuxième ou troisième formation orbitale moléculaire concernant la liaison de deux atomes car Sigma Molecular Orbital est la première liaison moléculaire à former entre deux atomes.
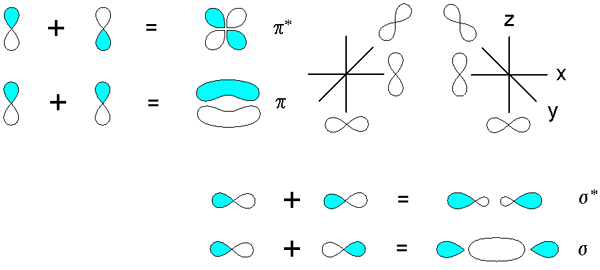
Figure 02: Orbitales moléculaires PI
De plus, le nombre d'atomes qui contribuent à une orbitale atomique p du système PI est toujours égal au nombre d'orbitales moléculaires PI présents dans une liaison chimique. En règle générale, l'orbitale moléculaire Pi la plus faible n'a aucun nœud vertical existant. Ici, les orbitales moléculaires PI successives obtiennent un nœud vertical supplémentaire en augmentant l'énergie. Nous pouvons abréger une orbitale moléculaire Pi comme π.
Quelle est la différence entre les orbitales moléculaires Sigma et Pi?
Les orbitales moléculaires Sigma et Pi sont deux types d'orbitales moléculaires qui contribuent à la structure réelle d'un composé chimique. La principale différence entre les orbitales moléculaires Sigma et Pi est que les formes orbitales moléculaires Sigma à partir du chevauchement des orbitales atomiques dans une direction tête à tête le long de l'axe internuclé.
L'infographie suivante répertorie les différences entre Sigma et Pi Molecular Orbitals sous forme tabulaire pour une comparaison côte à côte.
Résumé - Sigma vs Pi Molecular Orbitals
Une orbite moléculaire est un type d'orbital qui se forme à partir du chevauchement des orbitales atomiques. La principale différence entre les orbitales moléculaires Sigma et Pi est que les formes orbitales moléculaires Sigma à partir du chevauchement des orbitales atomiques dans une direction tête à tête le long de l'axe internuclé.
Référence:
1. «Qu'est-ce qu'une orbitale moléculaire sigma?" ByJus, 24 décembre. 2020.
1. «15.3: Pi Orbitales moléculaires du benzène." Chemistry LibreTexts, LibreTexts, 14 juillet 2020.
Image gracieuseté:
1. «Molécule d'hydrogène» par Chiraljon (CC par 2.0) via Flickr
2. «MO Diagram Pi Orbitals» par V8rik à EN.Wikipedia (CC BY-SA 3.0) via Commons Wikimedia


