Quelle est la différence entre l'acide protique et l'acide Lewis
Le différence clé entre l'acide protique et l'acide Lewis Est-ce que les acides protiques sont des donateurs de protons, tandis que les acides Lewis sont des accepteurs de protons.
Les acides protique sont des composés chimiques qui peuvent produire un proton ou un ion hydronium dans leur solution en libérant un proton. Un acide de Lewis est un composé chimique qui peut accepter une paire d'électrons d'une espèce chimique donnant des électrons.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide protique
3. Qu'est-ce que l'acide Lewis
4. Acide protique vs acide de Lewis sous forme tabulaire
5. Résumé - acide protique vs acide Lewis
Qu'est-ce que l'acide protique?
Les acides protique sont des composés chimiques qui peuvent produire un proton ou un ion hydronium en libérant un proton. Cette libération de proton se produit parce que ces acides peuvent accepter une paire d'électrons d'oh- ion dans l'eau en agissant comme un acide Lewis, mais il ne peut pas produire un ion hydronium ou un proton en soi.
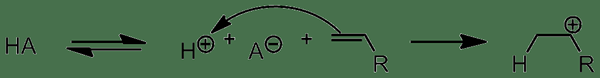
Figure 01: Action des acides protique
Il existe trois principaux types d'acides protiques comme acides monoprotiques, acides polyprotiques et acides diprotiques . Les acides monoprotiques peuvent libérer un proton à la solution, tandis que les acides diprotiques peuvent libérer deux protons. D'un autre côté, les acides polyprotiques peuvent libérer plus de deux protons. Dans les acides polyprotiques, les protons sont libérés en plusieurs étapes. Cependant, le premier proton est perdu plus facilement de l'acide que le proton suivant.
Qu'est-ce que l'acide Lewis?
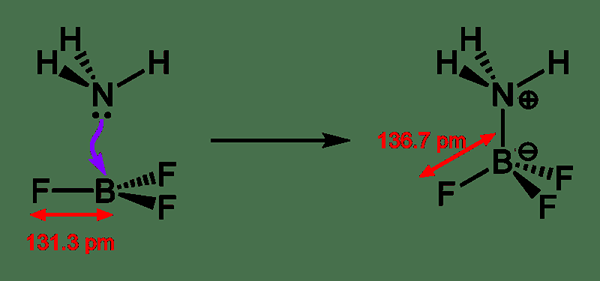
Un acide de Lewis est un composé chimique qui peut accepter une paire d'électrons d'une espèce chimique donnant des électrons. Ce type de composé acide contient une orbitale vide qui est capable d'accepter une paire d'électrons à partir d'une base de Lewis, formant un adduit Lewis. En revanche, la base de Lewis est une espèce chimique ayant une orbitale remplie composée d'une paire d'électrons. Cette paire d'électrons ne participe pas à la liaison, mais elle peut former des liaisons datives avec les acides Lewis pour former un adduit Lewis.

Figure 02: Formation d'un adduit de Lewis
En règle générale, le terme acide Lewis n'est utilisé qu'avec des composés chimiques planaires trigonaux contenant une orbitale p vide. Là, nous pouvons traiter des composés même complexes tels que Et3Al2CL3 comme des composés planaires trigonaux qui peuvent être nommés acides Lewis. Outre la formation des adduits de Lewis, d'autres réactions impliquant des acides Lewis sont appelées réactions catalysées par l'acide. Parfois, nous rencontrons des composés chimiques tels que H2O ayant à la fois des propriétés de base Lewis Acid et Lewis. En effet.
Il existe divers acides Lewis. Les acides Lewis les plus simples ont tendance à réagir facilement et directement avec les bases de Lewis. Les acides Lewis les plus courants ont tendance à subir une réaction chimique avant la formation de l'adduit. Certains exemples pour les acides Lewis comprennent les ions onium tels que l'ion d'ammonium et l'ion hydronium, les cations métalliques telles que l'ion ferrique, les espèces planaires trigonales telles que le BF3, les systèmes PI pauvres en électrons tels que les enones, etc. Les trois principaux types d'acides Lewis comprennent les acides Lewis simples, les acides Lewis complexes et l'acide H + Lewis. L'application la plus courante des acides Lewis est l'alkylation de Friedel-Crafts.
Quelle est la différence entre l'acide protique et l'acide Lewis?
Nous pouvons distinguer les acides protiques des acides Lewis par l'action de la libération de protons du composé acide. La principale différence entre l'acide protique et l'acide Lewis est que les acides protique sont des donneurs de protons, tandis que les acides Lewis sont des accepteurs de protons.
L'infographie suivante présente la différence entre l'acide protique et l'acide Lewis sous forme tabulaire.
Résumé - acide protique vs acide Lewis
En conclusion, les acides protiques diffèrent des acides Lewis en fonction de la capacité de ces composés à libérer des protons à la solution. La principale différence entre l'acide protique et l'acide Lewis est que les acides protique sont des donneurs de protons, tandis que les acides Lewis sont des accepteurs de protons.
Référence:
1. «Acides et bases polyprotiques." Chemistry LibreTexts, LibreTexts, 15 août. 2020.
Image gracieuseté:
1. «Initiation de l'acide protique» par matchm121 - propre travail (CC par 3.0) via Commons Wikimedia
2. «NH3-BF3-adduct-lingening-2d» par Ben Mills - propre travail (domaine public) via Commons Wikimedia


