Quelle est la différence entre l'inhibition non compétitive et allostérique
Le différence clé entre l'inhibition non compétitive et allostérique est que dans l'inhibition non concurrentielle, la vitesse maximale de réaction catalysée (VMAX) diminue et la concentration du substrat (km) reste inchangée, tandis que dans l'inhibition allostérique, le VMAX reste inchangé et km augmente.
Les enzymes sont essentielles pour la plupart des réactions qui se déroulent dans les organismes. Habituellement, une enzyme catalyse une réaction en réduisant l'énergie d'activation requise pour la réaction. Mais les enzymes doivent être régulées avec soin afin de contrôler les niveaux de produits finaux qui augmentent à des niveaux indésirables. Il est contrôlé par l'inhibition de l'enzyme. Un inhibiteur de l'enzyme est une molécule qui perturbe la voie de réaction normale entre une enzyme et un substrat.
Un site actif est la région d'une enzyme où les substrats se lient et subissent une réaction chimique. Un site allostérique est l'endroit où il permet aux molécules d'activer ou d'inhiber l'activité enzymatique. La cinétique enzymatique joue un rôle important pendant l'inhibition de l'enzyme. La vitesse maximale de réaction caractéristique d'une enzyme particulière à une concentration particulière est connue sous le nom de vitesse maximale ou Vmax. La concentration de substrat qui donne le taux qui est la moitié de Vmax est km.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'inhibition non compétitive
3. Qu'est-ce que l'inhibition allostérale
4. Similitudes - inhibition non compétitive et allostérique
5. Inhibition non compétitive vs allostérique sous forme tabulaire
6. Résumé - Inhibition non concurrentielle vs allostérique
Qu'est-ce que l'inhibition non compétitive?
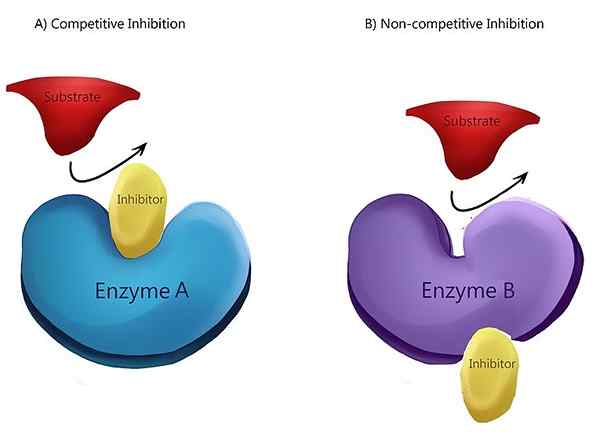
L'inhibition non compétitive est un type d'inhibition enzymatique où l'inhibiteur réduit l'activité enzymatique et se lie également bien à l'enzyme, qu'il soit lié au substrat ou non. En d'autres termes, une inhibition non concurrentielle est l'endroit où l'inhibiteur et le substrat se lient tous deux à l'enzyme à un moment donné. Lorsque le substrat et l'inhibiteur se lient à l'enzyme, il forme un complexe enzymatique-substrat-inhibiteur. Une fois ce complexe formé, il ne peut produire aucun produit. Il ne peut se reconvertir que le complexe enzymatique-substrat ou le complexe enzymatique-inhibiteur.

Figure 01: Inhibition non compétitive
Dans une inhibition non compétitive, l'inhibiteur a une affinité égale pour l'enzyme et le complexe enzymatique-substrat. Le mécanisme le plus courant d'un inhibiteur non compétitif est la liaison réversible de l'inhibiteur à un site allostérique. Mais l'inhibiteur a également la capacité de se lier directement au site actif. Un exemple d'inhibiteur non compétitif est la conversion de la pyruvate kinase en pyruvate. La conversion du phosphoenolpyruvate en pyruvate est catalysé par la pyruvate kinase. Un acide aminé appelé alanine, qui est synthétisé à partir du pyruvate, inhibe l'enzyme pyruvate kinase pendant la glycolyse. L'alanine agit comme un inhibiteur non compétitif.
Qu'est-ce que l'inhibition allostérale?
L'inhibition allostérique est un type d'inhibition enzymatique où l'inhibiteur ralentit l'activité enzymatique en désactivant l'enzyme et en se liant à l'enzyme au site allostérique. Ici, l'inhibiteur ne rivalise pas directement avec le substrat sur le site actif. Mais, il modifie indirectement la composition de l'enzyme. Une fois la forme modifiée, l'enzyme devient inactive. Ainsi, il ne peut plus se lier avec le substrat correspondant. Ceci, à son tour, ralentit la formation de produits finaux.
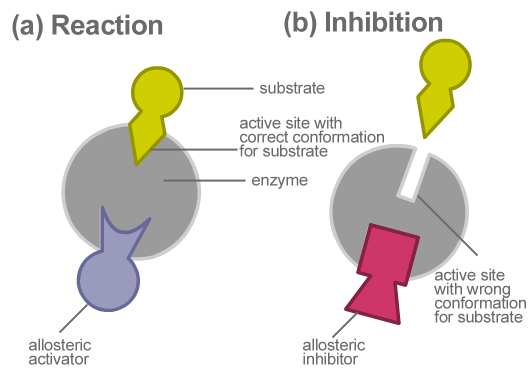
Figure 02: Inhibition allostérique
L'inhibition allostérique empêche la formation de produits inutiles, réduisant le gaspillage énergétique. Un exemple d'inhibition allostérique est la conversion de l'ADP en ATP en glycolyse. Ici, quand il y a un excès d'ATP dans le système, l'ATP sert d'inhibiteur allostérique. Il se lie à la phosphofructokinase, qui est l'une des enzymes impliquées dans la glycolyse. Cela ralentit la conversion ADP. En conséquence, l'ATP empêche la production inutile de lui-même. Par conséquent, une production excessive d'ATP n'est pas nécessaire lorsqu'il y a des montants adéquats.
Quelles sont les similitudes entre l'inhibition non compétitive et allostérique?
- Les deux types d'inhibitions enzymatiques ralentissent l'activité des enzymes.
- Les inhibiteurs des deux inhibitions enzymatiques ne rivalisent pas avec le substrat au site actif.
- Les inhibiteurs modifient indirectement la composition de l'enzyme.
- Les deux inhibiteurs modifient la forme de l'enzyme.
Quelle est la différence entre l'inhibition non compétitive et allostérique?
En inhibition non compétitive, le VMax de la réaction diminue tout en laissant la valeur KM inchangée. En revanche, dans l'inhibition allostérique, le VMax reste inchangé et la valeur KM augmente. C'est donc la principale différence entre l'inhibition non compétitive et allostérique. L'inhibition allostérique se concentre davantage sur l'utilisation de produits chimiques qui modifie l'activité enzymatique en se liant à un site allostérique, tandis que les inhibiteurs non compétitifs arrêtent toujours l'enzyme de travail en se liant directement à un site alternatif.
L'infographie suivante tabule les différences entre l'inhibition non concurrentielle et allostérique pour une comparaison côte à côte.
Résumé - Inhibition non concurrentielle vs allostérique
L'inhibition non compétitive est une inhibition de l'enzyme où l'inhibiteur réduit l'activité enzymatique et se lie également bien à l'enzyme, qu'il soit lié au substrat ou non. L'inhibition allostérique est un type d'inhibition enzymatique où l'inhibiteur ralentit l'activité enzymatique en désactivant l'enzyme et se lie à l'enzyme au site allostérique. La principale différence entre l'inhibition non concurrentielle et allostérique est que le taux maximal de réaction catalysée (VMAX) est réduit et que la concentration du substrat (km) reste inchangée dans l'inhibition non compétitive tandis que le VMAX reste inchangé, et le km est augmenté en allostérique inhibition.
Référence:
1. «Règlement allostérique: protocole."Jove.
2. «Enzymes.”Microbiologie sans limites.
Image gracieuseté:
1. «Inhibition des enzymes compétitives et non compétitives» par California16 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Inhibition allostérique» par [[: en: utilisateur: 1 | 1]] au Wikipedia en langue anglaise (CC BY-SA 3.0) via Commons Wikimedia


