Quelle est la différence entre le nitrate de plomb et le nitrate de zinc
Le Différence clé entre le nitrate de plomb et le nitrate de zinc est que le nitrate de plomb réagit avec l'hydroxyde d'ammonium, formant un précipité blanc qui n'est pas soluble dans une solution excessive d'hydroxyde d'ammonium, tandis que le nitrate de zinc réagit avec l'hydroxyde d'ammonium, formant un précipité blanc.
Le nitrate de plomb est un composé inorganique ayant la formule chimique PB (NO3) 2, tandis que le nitrate de zinc est un composé inorganique ayant la formule chimique Zn (NO3) 2 2.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le nitrate de plomb
3. Qu'est-ce que le nitrate de zinc
4. Nitrate de plomb vs nitrate de zinc sous forme tabulaire
5. Résumé - Nitrate de plomb contre nitrate de zinc
Qu'est-ce que le nitrate de plomb?
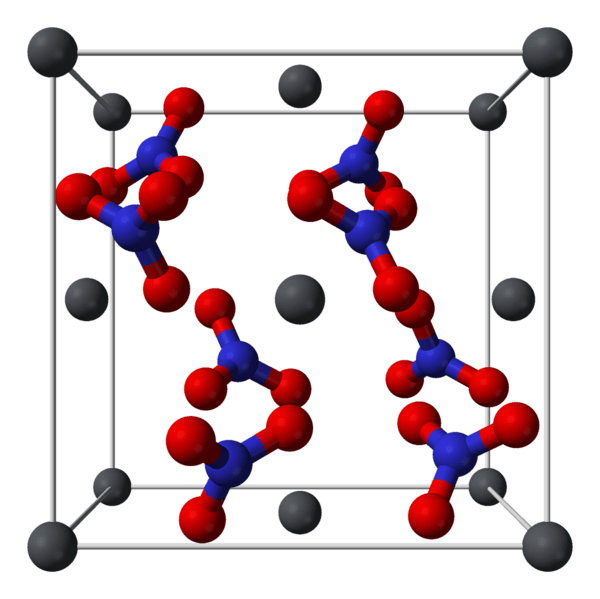
Le nitrate de plomb est un composé inorganique ayant la formule chimique PB (NO3) 2. Généralement, il existe comme un cristal incolore ou une poudre blanche. Il se décompose à des températures élevées. En règle générale, ce composé est toxique, et nous devons le manipuler avec soin afin d'éviter son inhalation, son ingestion et son contact cutané.
Nous pouvons produire des composés de nitrate de plomb par la réaction entre l'oxyde de plomb et l'acide nitrique concentré. Nous pouvons également le préparer à partir de l'évaporation de la solution obtenue par la réaction du plomb métallique avec de l'acide nitrique dilué. De plus, des cristaux de nitrate de plomb peuvent se former dans le traitement des déchets de bismuth au plomb à partir de raffineries de plomb.

Figure 01: La disposition atomique du composé de nitrate de plomb
Habituellement, le nitrate de plomb a tendance à se décomposer lors du chauffage. Ceci est utile en pyrotechnique. De plus, il est soluble dans l'eau et se dissout également dans l'acide nitrique dilué. Si nous ajoutons des composés alcalins à la solution, les nitrates de base. Nous pouvons utiliser le composé de nitrate de plomb pour la production de complexes de coordination. Dans ces complexes, l'ion de plomb est un accepteur dur et peut former de forts complexes en se combinant avec des ligands à don d'électrons d'azote et d'oxygène. E.g. combinaison de nitrate de plomb et de pentaéthylène glycol en présence de formes d'acétonitrile et de méthanol [Pb (non3)2(Eo5)] lors de l'évaporation.
Il existe peu d'applications de nitrate de plomb, y compris son utilisation comme stabilisateur de chaleur dans les polyesters en nylon sous la forme d'un revêtement pour le papier photothermographique et dans les rodenticides, dans le processus de cyanif.
Qu'est-ce que le nitrate de zinc?
Le nitrate de zinc est un composé inorganique ayant la formule chimique Zn (NO3) 2. C'est un sel cristallin blanc qui est très déliquescent. En règle générale, nous pouvons le trouver sous forme hexahydrée. De plus, cette substance est soluble dans l'eau et l'alcool.
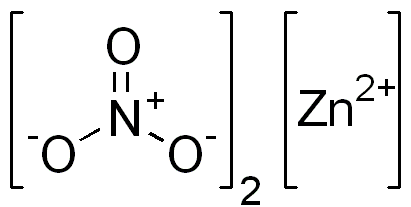
Figure 02: La structure chimique du nitrate de zinc
Nous pouvons produire du nitrate de zinc en dissolvant le zinc dans l'acide nitrique. Cependant, cette réaction dépend de la concentration. La réaction dans l'acide concentré forme également du nitrate d'ammonium. De plus, si nous chauffons le composé de nitrate de zinc, il peut subir une décomposition thermique afin de former de l'oxyde de zinc, du dioxyde d'azote et de l'oxygène.
Il existe quelques applications de nitrate de zinc, y compris, son utilisation dans la synthèse des polymères de coordination, la production de divers composés à base de ZnO, en tant que mordant dans la teinture, etc.
Quelle est la différence entre le nitrate de plomb et le nitrate de zinc?
Le nitrate de plomb et le nitrate de zinc sont des composés inorganiques ayant des applications importantes dans les industries. La principale différence entre le nitrate de plomb et le nitrate de zinc est sa réaction avec l'hydroxyde d'ammonium. Le nitrate de plomb réagit avec l'hydroxyde d'ammonium formant un précipité blanc qui n'est pas soluble dans une solution excessive d'hydroxyde d'ammonium, tandis que le nitrate de zinc réagit avec l'hydroxyde d'ammonium formant un précipitant blanc.
L'infographie ci-dessous présente les différences entre le nitrate de plomb et le nitrate de zinc sous forme tabulaire pour une comparaison côte à côte.
Résumé - Nitrate de plomb contre nitrate de zinc
Le nitrate de plomb et le nitrate de zinc sont des nitrates de cations en plomb et en zinc, respectivement. La principale différence entre le nitrate de plomb et le nitrate de zinc est que le nitrate de plomb réagit avec l'hydroxyde d'ammonium formant un précipité blanc qui n'est pas soluble dans une solution excessive d'hydroxyde d'ammonium, tandis que le nitrate de zinc réagit avec l'hydroxyde d'ammonium formant un précipité blanc.
Référence:
1.«Nitrate de zinc." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Lead (ii) -Nitrate-Unit-Cell-3D-balls» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia
2. «Nitrate de zinc» par Edgar181 - propre travail (domaine public) via Commons Wikimedia


