Quelle est la différence entre la loi de conservation de la masse et la loi de proportion constante
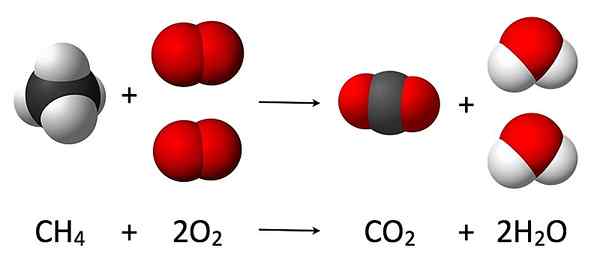
Le Différence clé entre la loi de conservation de la masse et la loi de proportion constante Est-ce que la loi de conservation de la masse explique que la matière ne peut pas être créée ou détruite mais convertie en autre.
Le droit de conservation de la masse et le droit des proportions constantes sont à la fois des lois en chimie qui sont liées à la masse.
CONTENU
1. Aperçu et différence clé
2. Quelle est la loi de conservation de la masse
3. Quelle est la loi de proportion constante
4. Loi de conservation de la masse contre la loi de proportion constante sous forme tabulaire
5. Résumé - Loi de conservation de la masse vs loi de proportion constante
Quelle est la loi de conservation de la masse?
La loi de conservation de la masse est une loi qui stipule que dans un système fermé, qui est fermé à tous les transferts de matière et d'énergie, la masse est constante dans le temps. Cela signifie que la masse du système ne peut pas changer avec le temps, de sorte que la quantité ne peut être ni ajoutée ni supprimée. En d'autres termes, la masse est conservée au fil du temps. Il est également connu comme le principe de la conservation de masse.
Selon cette loi, la masse ne peut ni être créée ni détruite bien qu'elle puisse être réorganisée dans l'espace. De plus, les entités qui y sont associées peuvent modifier les formulaires. E.g. La masse des réactifs dans une réaction chimique est équivalente à la masse des produits. Par conséquent, dans les réactions chimiques et les processus thermodynamiques à faible énergie qui se produisent dans des systèmes isolés, la masse totale de réactifs équivaut à la masse de produits.

Nous pouvons formuler la loi de conservation de la masse en mécanique classique où les échelles d'énergie associées à un système isolé sont relativement plus petites que MC2 (m est la masse d'un objet, et c est la vitesse de la lumière). Cela doit être mesuré dans le cadre de référence où l'objet se repose.
Quelle est la loi de proportion constante?
La loi de proportion constante affirme qu'un composé chimique donné peut toujours être composé de ses éléments composants dans un rapport fixe par masse. Cela ne dépend pas de sa source et de sa méthode de préparation. E.g. par masse, l'eau a environ 8/9 oxygène et 1/9 hydrogène.
Cependant, cette loi n'est pas universellement vraie. Par exemple, il existe des composés non stoichiométriques ayant une composition élémentaire qui peut varier d'un échantillon. Ces composés ont tendance à suivre la loi de plusieurs proportions. Par exemple, la wustite d'oxyde de fer peut contenir des atomes de fer dans la plage de 0.83 à 0.95 pour chaque atome d'oxygène (cela signifie qu'il est non stoichiométrique). Bien que sa formule chimique idéale soit FEO, les expériences cristallographiques le donnent comme Fe0.95O.
De plus, la composition isotopique d'un élément varie en fonction de la source; Par conséquent, il contribue même à la masse d'un composé stoechiométrique pur qui peut varier. Cette variation est utile dans la datation radiométrique.
Quelle est la différence entre la loi de conservation de la masse et la loi de proportion constante?
Le droit de conservation de la masse et le droit des proportions constantes sont à la fois des lois en chimie qui sont liées à la masse. La principale différence entre la loi de conservation de la masse et la loi de proportion constante est que la loi de conservation des affirmations de masse qui ne peut être créée ou détruite mais convertie en autre le même élément dans les mêmes proportions exactement par la masse.
Vous trouverez ci-dessous un résumé de la différence entre la loi de conservation de la masse et la loi de proportion constante sous forme tabulaire pour la comparaison côte à côte.
Résumé - Loi de conservation de la masse vs loi de proportion constante
La principale différence entre la loi de conservation de la masse et la loi de proportion constante est la loi de conservation de la masse explique que la matière ne peut pas être créée ou détruite mais convertie en autre élément dans les mêmes proportions exactement par la masse.
Référence:
1. «La loi de Proust en proportion constante." Chemistry LibreTexts, LibreTexts, 11 septembre. 2022.
Image gracieuseté:
1. «Réaction de combustion du méthane» par Jyntorobert A. Rohdejacek Fhjynto - Methane-3d-Space Remployer.molécule svgoxygen VDW.pngcarbon-dioxyde-3d-vdw.Molecule SVGWater 3D.SVG (domaine public) via Commons Wikimedia


