Quelle est la différence entre KM et Vmax
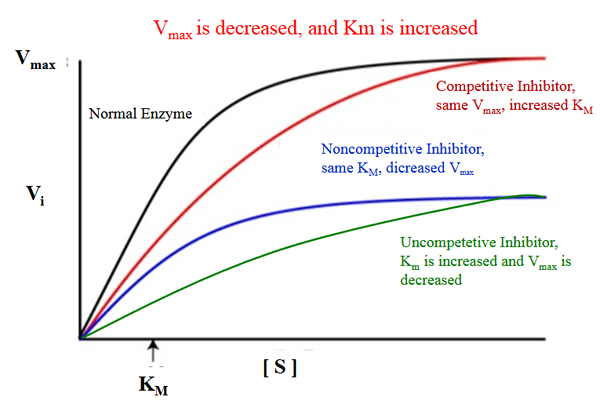
Le Différence clé entre KM et Vmax Est-ce que KM mesure la facilité avec laquelle une enzyme peut être saturée par le substrat, tandis que Vmax est la vitesse maximale à laquelle une enzyme est catalysée lorsque l'enzyme est saturée par le substrat.
KM peut être décrit comme la concertation du substrat à laquelle la moitié de la vitesse maximale est atteinte. Vmax, en revanche, peut être décrit comme la vitesse de réaction à l'état où l'enzyme est entièrement saturée par le substrat.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que KM
3. Qu'est-ce que Vmax
4. Km vs vmax sous forme tabulaire
5. Résumé - km vs vmax
Qu'est-ce que KM?
KM peut être décrit comme la concertation d'un substrat auquel la moitié de la vitesse maximale est atteinte. En d'autres termes, c'est la concentration de substrat qui permet à l'enzyme d'atteindre la moitié de Vmax. Par conséquent, une enzyme ayant un km élevé montre une faible affinité pour son substrat. Il nécessite également une plus grande concentration du substrat pour atteindre Vmax.
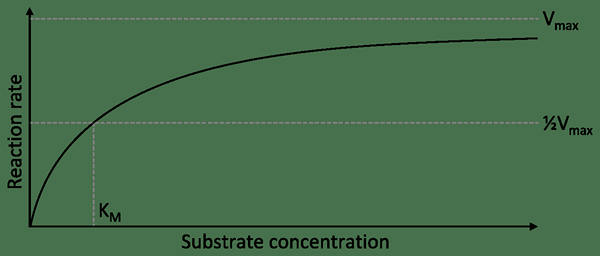
Le terme KM dans l'activité enzymatique est discuté sous la cinétique Michaelis-Menten. C'est un modèle commun de cinétique enzymatique. Ce modèle a été nommé d'après le biochimiste allemand Leonor Michaelis et le médecin canadien Maud Menten. Ce modèle est exprimé comme une équation.
v = d [p] / dt = vmax ([s] / km + [s])
Dans l'équation ci-dessus, le VMAX est le taux maximum atteint par le système qui se produit à la concentration de substrat saturée pour une concentration enzymatique donnée. KM est la constante de Michaelis. S'il est numériquement égal à la concentration du substrat, alors la vitesse de réaction est la moitié de la valeur de Vmax.
De plus, les réactions biochimiques avec un seul substrat sont souvent supposées montrer la cinétique de Michaelis-Menten sans souci de toute hypothèse sous-jacente de ce modèle.
Qu'est-ce que Vmax?
Vmax peut être décrit comme la vitesse de réaction à l'état où l'enzyme est entièrement saturée par le substrat. Cet état indique que tous les sites de liaison sont constamment réoccupés. En d'autres termes, Vmax est la vitesse de réaction ou la vitesse maximale d'une réaction qui est enzymatiquement catalysée lors de la saturation de l'enzyme avec son substrat.

Il est important de déterminer le KM et le VMAX pour une certaine activité enzymatique car la connaissance de ces valeurs nous permet de prédire le sort métabolique du substrat et la quantité relative de substrat qui passera par chaque voie dans des conditions différentes. Une valeur inférieure de Vmax indique que l'enzyme fonctionne dans des conditions sous-optimales.
Quelle est la différence entre KM et Vmax?
Les termes KM et Vmax sont importants dans la cinétique enzymatique. La principale différence entre KM et Vmax est que KM mesure la facilité avec laquelle l'enzyme peut être saturée par le substrat, tandis que le VMAX est la vitesse maximale à laquelle une enzyme est catalysée lorsque l'enzyme est saturée par le substrat.
Le tableau suivant résume la différence entre KM et Vmax.
Résumé - km vs vmax
KM est la concertation du substrat à laquelle la moitié de la vitesse maximale est atteinte. Vmax est la vitesse de réaction à l'état où l'enzyme est entièrement saturée par le substrat. La principale différence entre KM et Vmax est que KM mesure la facilité avec laquelle l'enzyme peut être saturée par le substrat, tandis que le VMAX est la vitesse maximale à laquelle une enzyme est catalysée lorsque l'enzyme est saturée par le substrat.
Référence:
1. «Quels sont les tests cinétiques enzymatiques? un aperçu." Tip biosystems, 20 janvier. 2022.
Image gracieuseté:
1. «Michaelis Menten Curve 2» par Thomas Shafee - propre travail (CC par 4.0) via Commons Wikimedia
2. «Courbe de cinétique enzymatique» par Imrankhan1992 - propre travail (CC0) via Commons Wikimedia


