Quelle est la différence entre les orbitales hybrides et non hybrides
Le Différence clé entre les orbitales hybrides et non hybrides Est-ce que les orbitales hybrides sont des hybrides ou des mélanges d'orbitales atomiques, tandis que les orbitales non hybrides sont des orbitales atomiques réguliers qui ne sont pas mélangés avec d'autres orbitales atomiques.
La compréhension des orbitales hybrides et non hybrides est très importante pour étudier et prédire les structures chimiques des composés chimiques. Les orbitales hybrides sont des combinaisons d'orbitales non hybrides.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hybridation orbitale
3. Que sont les orbitales hybrides
4. Quelles sont les orbitales non hybrides
5. Hybride vs orbitales non hybrides sous forme tabulaire
6. Résumé - Hybride vs orbitales non hybrides
Qu'est-ce que l'hybridation orbitale?
L'hybridation orbitale est un concept très important en chimie. Il s'agit du concept de mélange des orbitales atomiques et de former de nouvelles orbitales hybrides qui conviennent à l'appariement des électrons dans la formation de liaisons chimiques selon la théorie des liaisons de valence. Par exemple, un atome de carbone qui peut former quatre liaisons uniques contient quatre électrons de coque de valence en quatre orbitales hybrides qui se forment à partir de l'hybridation d'une orbitale atomique «s» avec trois orbitales atomiques p.
Les orbitales atomiques sont des représentations modèles du comportement des électrons au sein des molécules. Une hybridation simple est une approximation qui est faite sur la base d'orbitales atomiques qui sont similaires à ceux obtenus pour l'atome d'hydrogène. C'est le seul atome que nous pouvons résoudre l'équation de Schrodinger. Lorsque vous envisagez des atomes lourds comme le carbone et l'azote, les orbitales atomiques utilisent des orbitales atomiques 2S et 2P qui sont similaires aux orbitales d'état excités pour l'hydrogène.
Que sont les orbitales hybrides?
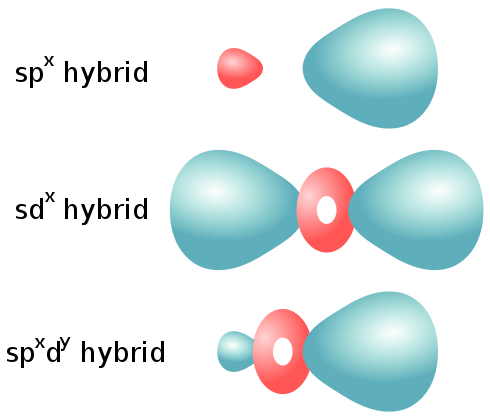
Les orbitales hybrides sont des orbitales atomiques mixtes ou combinés impliqués dans la liaison chimique. Ce sont des orbitales atomiques hybrides mixtes qui sont utiles dans l'explication de la géométrie moléculaire et des propriétés de liaison atomique. Ceux-ci sont disposés symétriquement dans l'espace. En règle générale, les orbitales hybrides se forment à partir du mélange d'orbitales atomiques d'énergies comparables.
Les orbitales hybrides peuvent être supposées comme des mélanges d'orbitales atomiques. Ceux-ci sont superposés les uns sur les autres dans diverses proportions. Par exemple, dans le méthane, il existe une liaison carbone-hydrogène dans laquelle l'orbital hybride de l'atome de carbone a 25% de caractère S et 75% de caractère. Par conséquent, il est décrit comme une orbite hybride SP3. Il existe différents types d'hybridations, y compris SP, SP2 et SP3.

Les orbitales SP se forment à partir de l'hybridation d'un S et d'une orbitale atomique. Ce type d'orbitales hybridés peut être trouvé dans les Alkynes ayant des obligations triples. Cette combinaison se traduit par deux orbitales hybrides SP et deux orbitales atomiques P restantes.
Généralement, l'hybridation est utile pour expliquer la forme moléculaire. En effet, l'angle entre les liaisons est approximativement égal à l'angle entre les orbitales hybrides.
Quelles sont les orbitales non hybrides?
Les orbitales non hybrides sont des orbitales atomiques régulières qui ne sont pas mélangées avec d'autres orbitales atomiques. Des orbitales atomiques P non hybrides sont utilisés dans la formation de liaisons π. En règle générale, deux orbitales atomiques P non hybrides provenant d'atomes différents peuvent se chevaucher d'un côté à l'autre, résultant en une paire d'électrons partagée qui occupe l'espace au-dessus et en dessous de la ligne qui rejoint les atomes.
Toutes les orbitales non hybrides sont dans l'état fondamental de l'atome. L'utilisation principale de ce type d'orbital est la formation de liaisons doubles et triples. Par exemple, dans l'hybridation SP3, il y a 4 orbitales atomiques hybrides SP3 et aucune orbitale non hybride. Par conséquent, ce type d'hybridation dans un atome peut former des liaisons à 4 sigma. Mais dans les hybridations SP2 et SP, il reste une et deux orbitales P non hybrides dans l'atome hybridé, respectivement. Ces orbitales P atomiques non hybrides sont impliquées dans la formation de triples et de doubles obligations, respectivement.
Quelle est la différence entre les orbitales hybrides et non hybrides?
La principale différence entre les orbitales hybrides et non hybrides est que les orbitales hybrides sont des hybrides ou des mélanges d'orbitales atomiques, tandis que les orbitales non hybrides sont des orbitales atomiques réguliers qui ne sont pas mélangés avec d'autres orbitales atomiques. Alors que les orbitales hybrides forment des obligations sigma, les orbitales non hybrides forment des obligations PI.
L'infographie ci-dessous présente les différences entre les orbitales hybrides et non hybrides sous forme tabulaire pour une comparaison côte à côte.
Résumé - Hybride vs orbitales non hybrides
La principale différence entre les orbitales hybrides et non hybrides est que les orbitales hybrides sont des hybrides ou des mélanges d'orbitales atomiques, tandis que les orbitales non hybrides sont des orbitales atomiques réguliers qui ne sont pas mélangés avec d'autres orbitales atomiques.
Référence:
1. «Orbitales hybrides." Chemistry LibreTexts, LibreTexts, 26 août. 2022.
Image gracieuseté:
1. «Formes des orbitales hybrides» par Officier781 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


