Quelle est la différence entre l'équation d'état et le coefficient d'activité
Le différence clé entre l'équation d'état et le coefficient d'activité Est-ce que l'équation d'état peut être appliquée à la fois pour les phases liquides et gazeuses, tandis que le coefficient d'activité est appliqué uniquement pour les gaz.
L'équation d'état et le coefficient d'activité sont des concepts chimiques importants. L'équation d'état peut être définie comme une équation thermodynamique liée aux variables d'état décrivant l'état de la matière dans certaines conditions physiques. Le coefficient d'activité est un facteur utile dans la thermodynamique pour la comptabilité des écarts qui provient d'un comportement idéal dans un mélange de substances chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'équation d'état
3. Qu'est-ce que le coefficient d'activité
4. Équation d'état vs coefficient d'activité sous forme tabulaire
5. Résumé - Équation de l'état vs coefficient d'activité
Qu'est-ce que l'équation d'état?
L'équation d'état peut être définie comme une équation thermodynamique liée aux variables d'état décrivant l'état de la matière dans certaines conditions physiques. Les conditions physiques qui peuvent être spécifiées comprennent la pression, le volume, la température et l'énergie interne. Cette équation est très importante pour expliquer les propriétés des fluides, des mélanges de liquide, des solides, etc.
Il n'y a pas d'équations d'État décrivant les propriétés de toutes les substances avec précision dans toutes les conditions. Par conséquent, nous décrivons les propriétés en utilisant l'état idéal des substances. Par exemple, le droit du gaz idéal est un type d'équation d'État. Cette équation est approximativement précise pour les gaz polaires faibles lorsque des pressions basses et des températures modérées sont considérées.
La forme générale de l'équation d'État peut être donnée comme suit:
f (p, v, t) = 0
Ici, P est une pression absolue, V est le volume et T est la température absolue. Loi classique du gaz idéal, droit de gaz idéal quantique, équations cubiques d'État, équations d'État non cubiques, équations viriales d'État, équations d'État SAFT, équations d'État multiparamètres, etc., sont certains types d'équations d'État.
Qu'est-ce que le coefficient d'activité?
Le coefficient d'activité est un facteur utilisé dans la thermodynamique pour la comptabilité des écarts qui proviennent d'un comportement idéal dans un mélange de substances chimiques. Lorsque vous envisagez un mélange idéal, les interactions microscopiques entre des paires d'espèces chimiques sont généralement similaires. Par conséquent, nous pouvons exprimer directement les propriétés des mélanges en termes de concentrations simples ou de pressions partielles des substances présentes. Un exemple de ceci est la loi de Raoult. Nous pouvons donner les écarts par rapport à l'idéalité en modifiant la concentration en utilisant un coefficient d'activité. L'opposé du coefficient d'activité est le coefficient de fugacité.

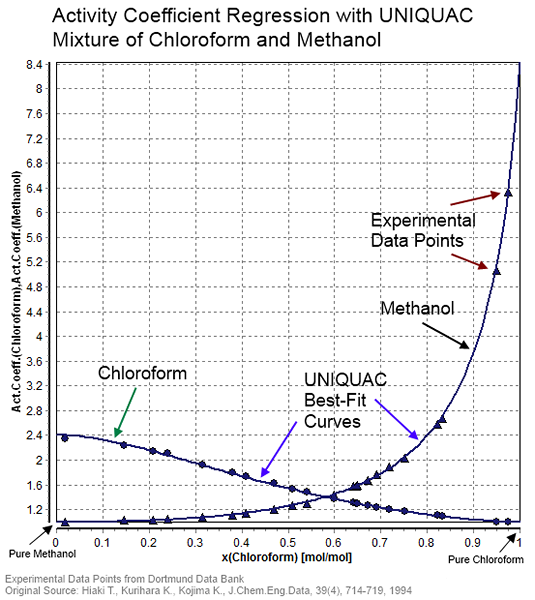
Figure 01: Coefficient d'activité pour un mélange de chloroforme et de méthanol
En règle générale, nous pouvons déterminer le coefficient d'activité grâce à des méthodes expérimentales. Cela se fait en effectuant des mesures sur des mélanges non idéaux. Les deux principales méthodes sont les méthodes radiochimiques et la méthode de dilution infinie. Par exemple. Nous pouvons obtenir le coefficient d'activité pour les mélanges binaires à la dilution infinie de chaque composant.
Quelle est la différence entre l'équation d'état et le coefficient d'activité?
L'équation d'état et le coefficient d'activité sont des concepts chimiques importants. L'équation d'état est une équation thermodynamique liée aux variables d'état décrivant l'état de matière dans certaines conditions physiques tandis que le coefficient d'activité est un facteur utilisé dans la thermodynamique pour la comptabilité des écarts qui proviennent d'un comportement idéal dans un mélange de substances chimiques. La principale différence entre l'équation d'état et le coefficient d'activité est que l'équation d'état peut être appliquée à la fois pour les phases liquides et gazeuses, tandis que le coefficient d'activité est appliqué uniquement pour les gaz. De plus, l'équation d'état est compliquée à utiliser alors que le coefficient d'activité est relativement simple à utiliser.
L'infographie suivante répertorie les différences entre l'équation d'état et le coefficient d'activité sous forme tabulaire pour une comparaison côte à côte.
Résumé - Équation de l'état vs coefficient d'activité
L'équation d'état et le coefficient d'activité sont des concepts chimiques importants. La principale différence entre l'équation d'état et le coefficient d'activité est que l'équation d'état peut être appliquée à la fois pour les phases liquides et gazeuses, tandis que le coefficient d'activité est appliqué uniquement pour les gaz.
Référence:
1. "Équation d'état." NASA.
Image gracieuseté:
1. «Uniquac Régression Chloroform Methanol» par Wilfriedc - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia