Quelle est la différence entre la réaction élémentaire et complexe
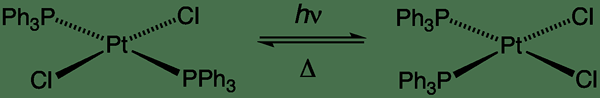
Le Différence clé entre les réactions élémentaires et complexes Est-ce que les réactions élémentaires ont essentiellement une seule étape, tandis que les réactions complexes ont essentiellement plusieurs étapes.
Nous pouvons classer les réactions chimiques de différentes manières. Mais il existe deux catégorisations de base comme réactions élémentaires et réactions complexes. Les réactions élémentaires ne comprennent qu'une seule sous-étape, tandis que les réactions complexes ont une série d'étapes et différents états de transition avec différents intermédiaires.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une réaction élémentaire
3. Qu'est-ce qu'une réaction complexe
4. Réaction élémentaire vs complexe sous forme tabulaire
5. Résumé - réaction élémentaire vs complexe
Quelle est la réaction élémentaire?
Une réaction élémentaire peut être définie comme une réaction chimique qui comprend une seule sous-étape. Dans ces réactions, une espèce chimique subit un changement direct pour donner le produit final en une étape. Ici, un seul état de transition est observé. Si nous ne pouvons pas détecter expérimentalement de produits intermédiaires pendant une réaction chimique, nous pouvons classer cette réaction comme une réaction élémentaire.
Types de réactions élémentaires
Il existe plusieurs types de réactions élémentaires comme suit:
- Réactions unimoléculaires
Dans une réaction unimoléculaire, un seul réactif subit une réaction comme une décomposition pour donner le ou les produits finaux (s) finaux. Certains exemples de réactions unimoléculaires incluent l'isomérisation des cis-trans.
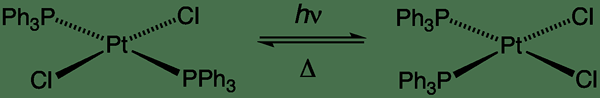
Figure 01: Un type d'isomérisation cis-trans
- Réactions bimoléculaires
Dans les réactions bimoléculaires, deux particules subissent une collision pour donner au (s) produit le (s) produit (s). Ce sont des réactions de second ordre car la vitesse de la réaction dépend des deux réactifs. Les réactions de substitution nucléophile sont un exemple.
- Réactions trimoléculaires
Dans une réaction trimoléculaire, trois particules subissent une collision en même temps pour donner au (s) produit le (s) produit (s). Cependant, ce type de réaction est rare car il est difficile pour trois réactifs de colliter en même temps.
Qu'est-ce qu'une réaction complexe?
Une réaction complexe peut être définie comme une réaction chimique qui comprend plusieurs sous-étapes. En d'autres termes, ces réactions ont une série d'étapes ainsi que différents états de transition avec différents intermédiaires. Par conséquent, ces réactions sont de nature très complexe.
Contrairement aux réactions élémentaires, l'ordre de la réaction n'est pas d'accord avec les coefficients stoechiométriques de la réaction. De plus, l'ordre de ces réactions peut être un entier ou une fraction.
Un exemple courant de ce type de réaction est la décomposition du peroxyde d'hydrogène, où il existe deux étapes différentes à partir desquelles nous pouvons obtenir la réaction globale de décomposition.
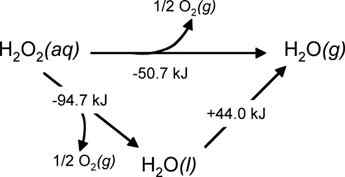
Figure 02: La décomposition du peroxyde d'hydrogène
Types de réactions complexes
Il existe trois principaux types de réactions complexes:
- Réactions consécutives
Ce type de réaction comprend une série de réactions irréversibles de premier ordre.
- Réactions parallèles
Les réactions parallèles incluent plusieurs étapes concernant la même réaction nette, et les réactions pas à pas se produisent parallèles les unes aux autres en même temps.
- Réactions réversibles
Les réactions réversibles sont des réactions chimiques dans lesquelles les réactifs forment des produits qui réagissent ensemble, formant les réactifs, qui impliquent au moins deux étapes de réactions élémentaires pour donner la même réaction nette.
Quelle est la différence entre la réaction élémentaire et complexe?
La principale différence entre les réactions élémentaires et complexes est que les réactions élémentaires ont essentiellement une seule étape, tandis que les réactions complexes ont essentiellement plusieurs étapes. De plus, les réactions élémentaires forment directement les produits, tandis que les réactions complexes forment un ou plusieurs intermédiaires avant de donner le produit final.
L'infographie ci-dessous présente les différences entre les réactions élémentaires et complexes sous forme tabulaire pour la comparaison côte à côte.
Résumé - réaction élémentaire vs complexe
Nous pouvons diviser les réactions chimiques en différents types. Mais il existe deux catégorisations de base comme réactions élémentaires et réactions complexes. La principale différence entre les réactions élémentaires et complexes est que les réactions élémentaires ont essentiellement une seule étape, tandis que les réactions complexes ont essentiellement plusieurs étapes.
Référence:
1. «9.4: réactions plus complexes." Chemistry LibreTexts, LibreTexts, 14 juillet 2020.
Image gracieuseté:
1. «CIS-TRANS-PTCL2P2» par Smokefoot - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Principes chimiques Fig2-5» par Charles A. Wight - Propre travaux (CC par 3.0) via Commons Wikimedia


