Quelle est la différence entre le catalyseur et l'intermédiaire
Le différence clé entre catalyseur et intermédiaire est qu'un catalyseur est utile au début de la réaction et est régénéré à la fin, tandis qu'un intermédiaire est formé pendant la réaction chimique et n'existe pas à la fin de la réaction.
Les termes catalyseur et intermédiaire sont très importants dans les réactions chimiques. Un catalyseur est un composé chimique qui peut augmenter le taux d'une réaction sans être consommé, tandis qu'un intermédiaire est une molécule qui se forme à partir de deux ou plusieurs réactifs et subit une réaction supplémentaire pour donner des produits finaux.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un catalyseur
3. Qu'est-ce qu'un intermédiaire
4. Catalyseur vs intermédiaire sous forme tabulaire
5. Résumé - Catalyseur vs intermédiaire
Qu'est-ce qu'un catalyseur?
Un catalyseur est un composé chimique qui peut augmenter le taux d'une réaction sans être consommé. Par conséquent, ce composé peut continuer à agir à plusieurs reprises. Pour cette raison, seule une petite quantité de catalyseur est nécessaire pour une certaine réaction chimique.
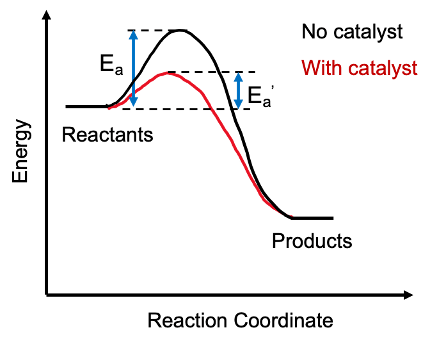
Un catalyseur fournit une voie alternative pour une réaction chimique en réduisant l'énergie d'activation d'une réaction. Ici, le catalyseur se combine avec le réactif pour créer un produit intermédiaire, et après la fin de la réaction requise, le catalyseur laisse l'intermédiaire et se régénère.
Il existe deux types de catalyseurs; Ce sont des catalyseurs homogènes et hétérogènes. Dans les catalyseurs homogènes, les molécules sont dans la même phase que les molécules de réactif. Cependant, dans les catalyseurs hétérogènes, les molécules sont dans une phase différente de celle des molécules de réactif. Les enzymes sont un bon exemple de catalyseurs biologiques.
Qu'est-ce qu'un intermédiaire?
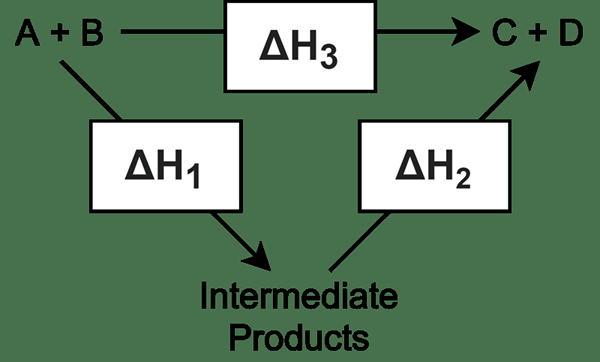
Un intermédiaire est une molécule qui se forme à partir de deux ou plusieurs réactifs et subit d'autres réactions pour donner des produits finaux. Un intermédiaire est formé en réactions en plusieurs étapes. La plupart du temps, les réactions chimiques complexes nécessitent plus d'une étape pour terminer la réaction pour obtenir le produit final souhaité. Dans ces réactions, toutes les étapes de réaction autres que la dernière étape donnent des intermédiaires; La dernière étape donne le produit plutôt que de donner un intermédiaire. Par conséquent, un intermédiaire est instable, et il a tendance à subir rapidement une réaction supplémentaire.

En règle générale, les intermédiaires se produisent très rarement dans le mélange réactionnel en raison de leur nature instable. Ils existent pendant une courte période. De plus, il est très difficile d'isoler un intermédiaire car il a tendance à réagir plus loin. Dans une réaction particulière, il peut y avoir un nombre très élevé de molécules intermédiaires à chaque étape de réaction. Parfois, il est très difficile d'identifier ces molécules.
Nous pouvons faire la distinction entre les intermédiaires et les vibrations moléculaires. Ceux-ci ont généralement des durées de vie similaires et ne sont que des transitions. Habituellement, ces molécules sont très réactives. Un bon exemple serait l'estérification d'un diol, où un monoester est produit dans la première étape, et un dioester se forme dans la deuxième (dernière étape).
Quelle est la différence entre le catalyseur et l'intermédiaire?
La principale différence entre le catalyseur et l'intermédiaire est qu'un catalyseur est utile au début de la réaction et est régénéré à la fin, tandis qu'un intermédiaire est formé pendant la réaction chimique et n'existe pas à la fin de la réaction. De plus, les catalyseurs sont stables, tandis que les intermédiaires sont très instables.
L'infographie ci-dessous présente les différences entre le catalyseur et l'intermédiaire sous forme tabulaire pour une comparaison côte à côte.
Résumé - Catalyseur vs intermédiaire
La principale différence entre le catalyseur et l'intermédiaire est qu'un catalyseur est ajouté au début de la réaction et régénéré à la fin de la réaction alors qu'un intermédiaire est formé pendant la réaction et n'est pas régénéré à la fin de la réaction.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Qu'est-ce qu'un intermédiaire de réaction?"Thoughtco, août. 27, 2020.
Image gracieuseté:
1. «Catalyst Energy Diagram» par Emma Ambrogi - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Hess Cycle Diagram» par SGDWN - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


