Quelle est la différence entre l'ammoniac et le trifluorure de bore
Le Différence clé entre l'ammoniac et le trifluorure de bore est que l'ammoniac est une molécule polaire, tandis que le trifluoride de bore est une molécule non polaire.
L'ammoniac et le trifluoride de bore ont une atomicité similaire et une connectivité étroitement similaire des atomes, mais il y a une paire d'électrons solitaires sur l'atome d'azote dans la molécule d'ammoniac alors qu'il n'y a pas d'électrons solitaires sur l'atome de bore dans le trifluoride de bore. Ce fait fait de l'ammoniac une molécule polaire et un trifluorure de bore une molécule non polaire.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ammoniac
3. Qu'est-ce que le trifluorure de bore
4. Ammoniac vs trifluorure de bore sous forme tabulaire
5. Résumé
Qu'est-ce que l'ammoniac?
L'ammoniac est un composé inorganique ayant la formule chimique NH3. C'est une substance gazeuse et est l'hydrate de pnictogène le plus simple. L'ammoniac se produit comme un gaz incolore ayant une odeur piquante et irritante. Le nom IUPAC de l'ammoniac est azane. La masse molaire de l'ammoniac est 17.03 g / mol. Son point de fusion est de -77.73 ° C, et son point d'ébullition est -33.34 ° C.
Lorsque l'on considère la survenue de gaz d'ammoniac, elle se produit naturellement dans l'environnement mais en quantité de traces en tant que produit de matière azotée et végétale. Parfois, nous pouvons également trouver de l'ammoniac dans l'eau de pluie. À l'intérieur de notre corps, les reins sécrètent de l'ammoniac pour neutraliser l'excès d'acide.
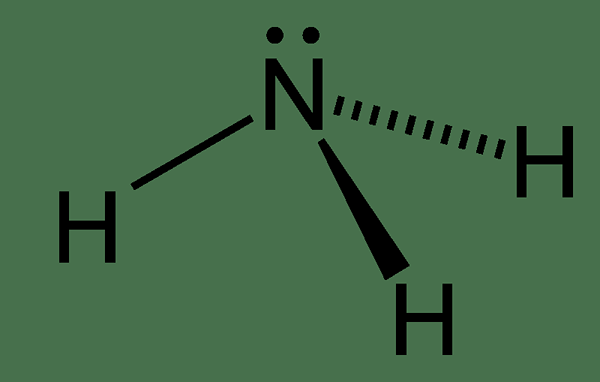
Figure 01: Ammoniac
La structure chimique de la molécule d'ammoniac a un atome d'azote lié à trois atomes d'hydrogène. Puisqu'il y a cinq électrons dans la coque d'électrons la plus externe d'azote, il y a une paire d'électrons solitaires sur l'atome d'azote de la molécule d'ammoniac. Par conséquent, la géométrie de la molécule d'ammoniac est pyramidale trigonale. De plus, nous pouvons facilement liquéfier ce composé. En effet.
Qu'est-ce que le trifluorure de bore?
Le trifluorure de bore est un composé inorganique ayant la formule chimique BF3. C'est un gaz piquant qui est incolore et toxique. Il peut former des fumées blanches dans l'air humide. Cependant, il existe deux formes majeures de trifluoride de bore comme forme anhydre et forme de dihydrate; La forme anhydre est un gaz incolore, tandis que la forme de dihydrate est un liquide incolore. Lorsque l'on considère leur solubilité dans l'eau, la forme anhydre a tendance à subir une décomposition exothermique lorsqu'elle est ajoutée à l'eau, tandis que la forme de dihydrate est très soluble dans l'eau. Cette substance est corrosive, nous devons donc utiliser en acier inoxydable, monel et hastelloy pour le stockage de cette substance.

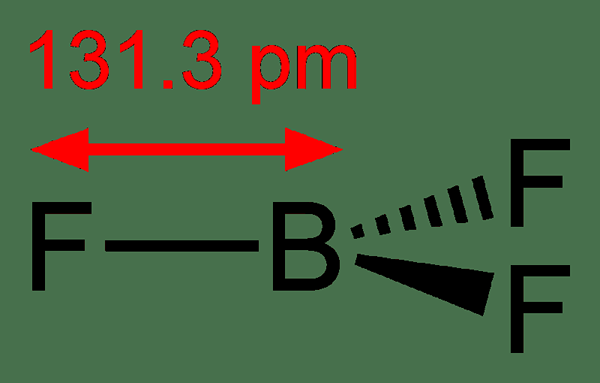
Figure 02: trifluorure de bore
La molécule de trifluorure de bore a une géométrie plane trigonale. Il n'a pas de moment dipolaire à cause de sa symétrie. Cette molécule est isoélectronique avec un anion carbonate. En termes communs, nous appelons le trifluorure de bore une espèce chimique déficiente en électrons. Il a une réactivité exothermique avec les bases de Lewis.
Dans la synthèse du trifluorure de bore, nous pouvons le produire à partir de la réaction entre les oxydes de bore et le fluorure d'hydrogène. Cependant, dans les besoins en laboratoire, nous pouvons produire du trifluoride de bore à l'aide d'éthéré de trifluorure de bore (un liquide disponible dans le commerce).
Quelle est la différence entre l'ammoniac et le trifluorure de bore?
L'ammoniac et le trifluoride de bore sont des molécules à 4 atomes, tous deux ayant un atome central lié à trois autres atomes. Cependant, contrairement à la molécule de trifluorure de bore, il y a une paire d'électrons solitaires dans la molécule d'ammoniac, ce qui le rend polaire. Par conséquent, la principale différence entre l'ammoniac et le trifluoride de bore est que l'ammoniac est une molécule polaire, tandis que le trifluorure de bore est une molécule non polaire.
L'infographie suivante énumère la différence entre l'ammoniac et le trifluorure de bore sous forme tabulaire pour une comparaison côte à côte.
Résumé - Trifluorure d'ammoniac vs bore
L'ammoniac est un composé inorganique ayant la formule chimique NH3, tandis que le trifluorure de bore est un composé inorganique ayant la formule chimique BF3. La principale différence entre l'ammoniac et le trifluorure de bore est que l'ammoniac est une molécule polaire, tandis que le trifluorure de bore est une molécule non polaire.
Référence:
1. «Synthèse de l'ammoniac: processus et réaction." Étude.com
Image gracieuseté:
1. «Ammoniac-2d» par Radio89 - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Boron-Trifluorride-2d-dimensions» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


