Quelle est la différence entre les enzymes allostériques et non allostériques
Le différence clé Entre les enzymes allostériques et non-altérales est que les enzymes allostériques ont des sites allostériques autres que leurs sites actifs pour la liaison des molécules régulatrices, tandis que les enzymes non allostériques n'ont qu'un site actif pour se lier au substrat.
Il existe différentes manières de régulation enzymatique. La régulation allostérique est une telle forme de régulation enzymatique. La régulation allostérique est facilitée par des enzymes appelées enzymes allostériques. Les molécules régulatrices se lient aux sites allostériques possédés par l'enzyme et régulent l'activité enzymatique. Par conséquent, les enzymes allostériques sont également connues sous le nom d'enzymes régulatrices. La spécialité des enzymes allostériques est qu'ils possèdent des sites supplémentaires autres que le site actif principal.
CONTENU
1. Aperçu et différence clé
2. Que sont les enzymes allostériques
3. Quelles sont les enzymes non altéologiques
4. Similitudes - enzymes allostériques vs non alélotérales
5. Allosterique vs enzymes non alétériques sous forme tabulaire
6. Résumé - enzymes allostériques vs non allostériques
Que sont les enzymes allostériques?
Les enzymes allostériques sont un type d'enzyme qui possède des sites allostériques pour la liaison des molécules régulatrices. Ces sites sont situés dans les différentes sous-unités protéiques de l'enzyme. Une molécule régulatrice peut être un inhibiteur ou un activateur. Lorsqu'un inhibiteur se lie à l'enzyme, l'activité enzymatique diminue. Lorsqu'un activateur se lie à l'enzyme, la fonction enzymatique augmente. Ce type de régulation de l'activité enzymatique est connu sous le nom de régulation allostérique. Une enzyme allostérique est spécifique à son substrat et à ses molécules régulatrices (modulateurs). L'interaction de la molécule / modulateur régulateur avec l'enzyme est réversible et non covalente. Une réaction catalysée par une enzyme allostérique montre une courbe sigmoïde.

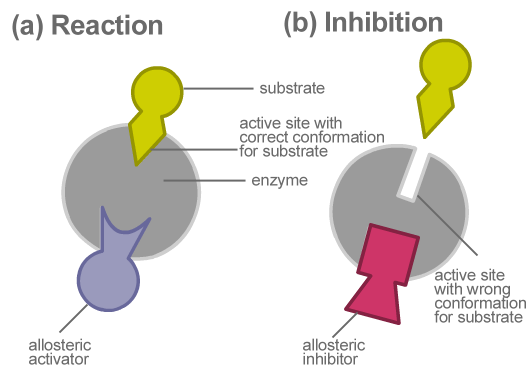
Figure 01: Inhibition allostérique
La réglementation allostérique a lieu en tant que mécanisme de rétroaction. Dans l'inhibition de la rétroaction négative, la molécule régulatrice est un inhibiteur, et il inhibe la réaction. Dans un mécanisme de rétroaction positif, une molécule ou un activateur effecteur qui se lie au site allostérique augmente le taux de réaction. La liaison du modulateur allostérique à une enzyme allostérique modifie la conformation de la protéine, affectant ainsi sa fonction. La pyruvate kinase, la ribonucléotide réductase, l'aspartate transcarbamoylase et la pyrophosphorylase ADP-glucose sont plusieurs exemples d'enzymes allostériques.
Quelles sont les enzymes non altéologiques?
Les enzymes non altérestérales sont les enzymes qui ne traitent pas des sites allostériques autres que le site actif. Par conséquent, ce sont des enzymes simples qui n'ont qu'un seul site actif enzymatique. Ces enzymes sont des enzymes spécifiques au substrat. Ce sont aussi des enzymes non réglementaires. Leurs réactions montrent une courbe hyperbolique.
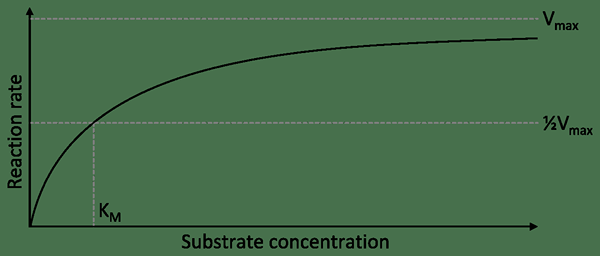
Figure 02: Courbe hyperbolique montrée par une enzyme non altérérique
Lorsqu'il y a un inhibiteur concurrentiel, la vitesse de réaction diminue. Un inhibiteur concurrentiel est similaire au substrat. Par conséquent, il rivalise avec le substrat pour la liaison avec le site actif. Lorsque le substrat ne se lie pas au site actif, le complexe substrat-enzyme ne peut pas être formé, donc la vitesse de réaction diminue.
Quelles sont les similitudes entre les enzymes allostériques et non allostériques?
- Les enzymes allostériques et non allostériques sont deux types d'enzymes.
- Ils sont constitués de protéines.
- Ils catalysent les réactions biochimiques dans les cellules vivantes.
- Les deux types d'enzymes restent inchangés à la fin de la réaction.
- Une petite concentration de ces enzymes suffit pour catalyser une réaction.
- Ils sont sensibles aux changements de pH et de température.
Quelle est la différence entre les enzymes allostériques et non allostériques?
Une enzyme allostérique est une enzyme qui a un site supplémentaire appelé site de régulation ou site allostérique pour la liaison d'une molécule régulatrice. Une enzyme non altérérique est une enzyme simple qui n'a qu'un site actif pour la liaison de son substrat. C'est donc la principale différence entre les enzymes allostériques et non alélotérales.
L'infographie suivante énumère les différences entre les enzymes allostériques et non allostériques sous forme tabulaire pour une comparaison côte à côte.
Résumé - enzymes allostériques vs non allostériques
L'enzyme allostérique est une enzyme régulatrice qui possède un site allostérique autre que le site actif. Par conséquent, une molécule régulatrice peut se lier avec le site allostérique et réguler l'activité enzymatique. En revanche, l'enzyme non altérérique n'a pas de site allostérique. Il n'a qu'un site actif. Les enzymes non altérestérales ne sont pas des enzymes régulatrices. Les enzymes allostériques sont à la fois spécifiques à la molécule de substrat et à la molécule régulatrice, tandis que les enzymes non alétériques sont spécifiques au substrat. Ainsi, c'est le résumé de la différence entre les enzymes allostériques et non alélotérales.
Référence:
1. «Régulation enzymatique (article).”Khan Academy.
2. «Enzymes.»Lumen.
Image gracieuseté:
1. «Inhibition allostérique» par [[: en: utilisateur: 1 | 1]] au Wikipedia en langue anglaise (CC BY-SA 3.0) via Commons Wikimedia
2. «Michaelis Menten Curve 2» par Thomas Shafee - propre travail (CC par 4.0) via Commons Wikimedia


