Quelle est la différence entre la modulation allostérale et covalente
Le différence clé entre la modulation allostérale et covalente est cette modulation allostérique nécessite une enzyme de phosphatase, tandis que la modulation covalente nécessite une enzyme kinase.
La modulation d'une enzyme est une modification du site dans lequel un récepteur ou un ligand va se lier à une enzyme. Il existe différents types de modulations, et la modulation allostérique et covalente en est deux.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la modulation allostérale
3. Qu'est-ce que la modulation covalente
4. Allostérique vs modulation covalente sous forme tabulaire
5. Résumé - Allosterique vs modulation covalente
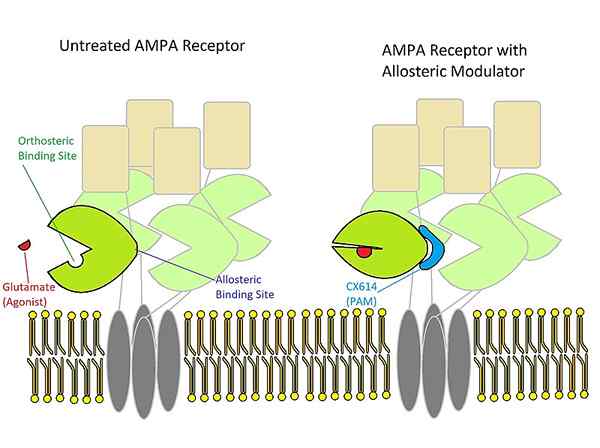
Qu'est-ce que la modulation allostérale?
La modulation allostérique est un terme en pharmacologie et en biochimie qui fait référence à un groupe de substances qui se lient à un récepteur pour changer la réponse de ce récepteur au stimulus. Certains de ces modulateurs sont des médicaments, e.g. benzodiazépines. Le site allostérique est le site auquel un modulateur allostérique se lie. Ce n'est pas le même à lequel l'agoniste endogène du récepteur va se lier (ce site particulier est nommé le site orthostérique). Nous pouvons appeler les modulateurs et les agonistes comme ligands récepteurs.

De plus, il existe trois principaux types de modulateurs allostériques: les modulations positives, négatives et neutres. Le type positif peut augmenter la réponse du récepteur en augmentant la probabilité de la liaison de l'agoniste avec un récepteur, en augmentant la capacité d'activer le récepteur (c'est ce qu'on appelle l'efficacité), ou de ces deux manières. D'un autre côté, le type négatif peut réduire l'affinité et l'efficacité des agonistes. Enfin, le type neutre n'affecte pas l'activité agoniste, mais elle peut empêcher d'autres modulateurs de se lier à un site allostérique. De plus, certains modulateurs allostériques travaillent comme des agonistes allostériques.
Généralement, les modulateurs allostériques sont capables de modifier l'affinité et l'efficacité d'autres substances qui agissent sur un récepteur. Un modulateur peut également augmenter l'affinité et la moindre efficacité ou vice versa. L'affinité est la capacité d'une substance à se lier à un récepteur. L'efficacité, en revanche, est la capacité d'une substance à activer un récepteur qui est donné en pourcentage de la capacité de la substance à activer le récepteur par rapport à l'agoniste endogène du récepteur.
Qu'est-ce que la modulation covalente?
La modulation covalente est un terme important utilisé en biochimie, et il fait référence à un groupe de substances qui se lient de manière covalente à un récepteur, modifiant sa réponse. Les enzymes peuvent être régulées par le transfert d'une molécule ou d'un atome d'un donneur à une chaîne latérale d'acide aminé qui peut servir de récepteur de la molécule transférée. L'autre façon de le faire est de modifier la séquence d'acides aminés elle-même via le clivage protéolytique.
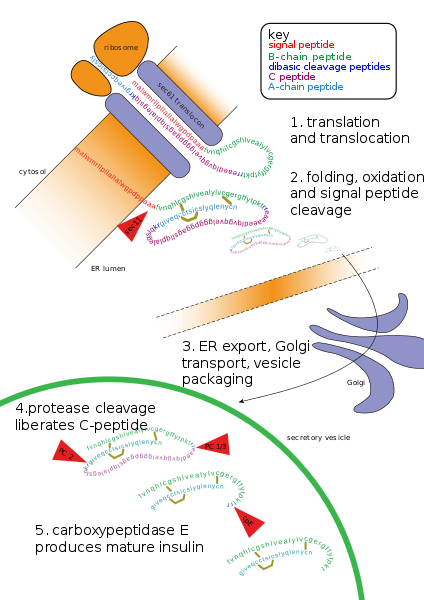
La modulation covalente implique l'altération de la forme et la fonction d'une enzyme via la liaison covalente de groupes chimiques. De plus, cette modulation est également connue sous le nom de modification post-traductionnelle. Habituellement, cette modulation se déroule dans le réticulum endoplasmique et l'appareil Golgi. Les sites qui peuvent souvent subir une modification post-traductionnelle sont les sites ayant un groupe fonctionnel servant de nucléophile dans la réaction. Ces sites comprennent des groupes hydroxyles de sérine, de thréonine et de tyrosine, ainsi que les formes amines de lysine, d'arginine et d'histidine.
Quelle est la différence entre la modulation allostérale et covalente?
La principale différence entre la modulation allostérale et covalente est que la modulation allostérique nécessite une enzyme de phosphatase, tandis que la modulation covalente nécessite une enzyme kinase.
L'infographie ci-dessous présente les différences entre la modulation allostérale et covalente sous forme tabulaire pour comparaison côte à côte.
Résumé - Allosterique vs modulation covalente
La modulation allostérique fait référence à un groupe de substances qui se lient à un récepteur pour changer la réponse de ce récepteur à un stimulus, tandis que la modulation covalente se réfère à un groupe de substances qui se lient de manière covalente à un récepteur et modifie sa réponse. La principale différence entre la modulation allostérale et covalente est que la modulation allostérique nécessite une enzyme de phosphatase, tandis que la modulation covalente nécessite une enzyme kinase.
Référence:
1. «Modulation allostérique covalente." Laboratoire de Londres, 25 juin 2015.
Image gracieuseté:
1. «Récepteur AMPA - Modulation allostérique» par Ikenhower - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Path d'insuline» par téléchargé par Fred The Oyster (CC BY-SA 4.0) via Commons Wikimedia


