Différence entre valence et numéro d'oxydation
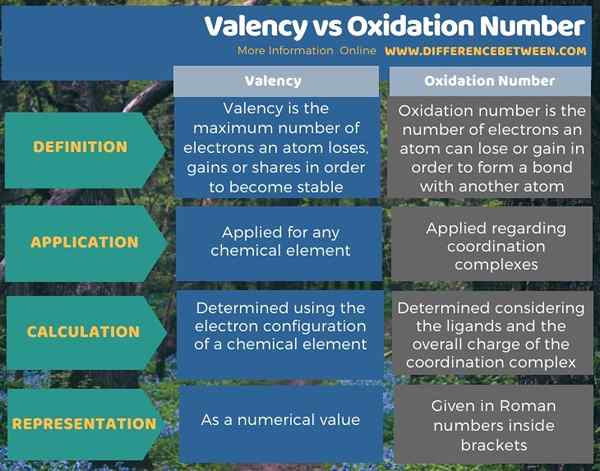
Le différence clé entre la valence et le nombre d'oxydation est que La valence est le nombre maximum d'électrons qu'un atome peut perdre, gagner ou partager pour devenir stable, tandis que le nombre d'oxydation est le nombre d'électrons qu'un atome peut perdre ou gagner pour former une liaison avec un autre atome.
Les termes le numéro d'oxydation et la valence sont liés aux électrons de valence d'un atome. Les électrons de valence sont les électrons qui occupent les orbitales les plus externes d'un atome. Ces électrons ont une faible attraction vers le noyau atomique; Ainsi, les atomes peuvent facilement retirer ou partager ces électrons avec d'autres atomes. Cette perte, le gain ou le partage d'électrons font que un atome particulier a un numéro d'oxydation et une valence, et finalement il forme une liaison chimique entre les deux atomes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la valence
3. Qu'est-ce que le numéro d'oxydation
4. Comparaison côte à côte - Valency vs Numéro d'oxydation sous forme tabulaire
5. Résumé
Qu'est-ce que la valence?
La valence est le nombre maximum d'électrons un atome perd, gains ou actions pour devenir stable. Pour les métaux et les non-métaux, la règle des octets décrit la forme la plus stable d'un atome. Ici, si le nombre de la coquille le plus externe d'un atome est complètement rempli (a besoin de huit électrons pour cette fin), cette configuration d'électrons est stable. En d'autres termes, si les sous-orbitales S et P sont complètement remplies avec NS2NP6 configuration, l'atome est stable.
Naturellement, les atomes de gaz nobles ont cette configuration d'électrons. Par conséquent, d'autres éléments doivent perdre, gagner ou partager des électrons pour obéir à la règle des octets. Le nombre maximum d'électrons qu'un atome doit perdre, gagner ou partager dans cette stabilisation est la valence de cet atome.
Par exemple, considérons le silicium. La configuration électronique du silicium est 122s22p63s23p2. La coque la plus externe est n = 3, et il a 4 électrons. Par conséquent, il devrait obtenir quatre autres électrons pour compléter l'octet. Généralement, le silicium peut partager 4 électrons avec d'autres éléments pour compléter l'octet. Ainsi, la valence du silicium est 4.
Pour différents éléments chimiques, la valence diffère. C'est parce que les électrons sont remplis aux orbitales en fonction des niveaux d'énergie de ces orbitales. Cependant, la plupart des métaux de transition ont la même valence; C'est souvent 2. Mais, certains éléments peuvent avoir des valences de différence car l'atome peut se stabiliser dans différentes configurations d'électrons en supprimant les électrons.
Par exemple, en fer (FE), la configuration d'électrons est [ar] 3D64s2. Par conséquent, la valence du fer est de 2 (2 électrons en 4S2). Mais parfois, la valence du fer devient 3. C'est parce que la 3D5 La configuration d'électrons est plus stable que 3D6. Ainsi, le retrait d'un électron de plus avec des électrons 4S stabilisera plus de fer.
Qu'est-ce que le numéro d'oxydation?
Le numéro d'oxydation est le nombre d'électrons qu'un atome peut perdre ou gagner pour former une liaison avec un autre atome. Parfois, nous utilisons les termes l'état d'oxydation et le numéro d'oxydation de manière interchangeable, mais ils ont de légères différences.
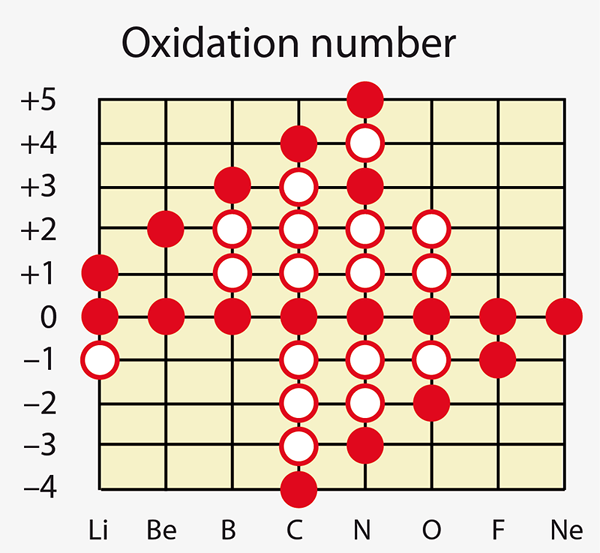
Figure 01: Certains éléments chimiques peuvent montrer différents nombres d'oxydation
La plupart du temps, le terme numéro d'oxydation est appliqué pour les complexes de coordination. Dans les complexes de coordination, le nombre d'oxydation est la charge de l'atome central d'un composé de coordination si toutes les liaisons autour de cet atome étaient des liaisons ioniques. Les complexes de coordination sont presque toujours composés d'atomes de métal de transition au centre du complexe. Cet atome métallique a des groupes chimiques dans son environnement, que nous nommons comme des ligands. Ces ligands ont des paires d'électrons solitaires qui peuvent être partagées avec les atomes métalliques pour former des liaisons de coordination.
Après la formation de la liaison de coordination, elle est similaire à une liaison covalente. C'est parce que les deux atomes des liaisons de coordination partagent une paire d'électrons, tout comme une liaison covalente. Cependant, nous devons calculer le nombre d'oxydation de l'atome métallique central compte tenu des liaisons de coordination sous forme de liaisons ioniques.
Quelle est la différence entre la valence et le numéro d'oxydation?
Les termes le numéro d'oxydation et la valence sont liés aux électrons de valence d'un atome. La principale différence entre la valence et le nombre d'oxydation est que la valence est le nombre maximum d'électrons qu'un atome peut perdre, gagner ou partager pour devenir stable tandis que le nombre d'oxydation est le nombre d'électrons qu'un atome peut perdre ou gagner pour former une liaison avec un autre atome. De plus, le terme valence est appliqué pour tout élément chimique, mais le terme numéro d'oxydation est appliqué principalement en ce qui concerne les complexes de coordination.
L'infographie ci-dessous résume la différence entre la valence et le numéro d'oxydation.

Résumé - Valence vs Numéro d'oxydation
Le nombre d'oxydation et la valence sont des termes liés aux électrons de valence d'un atome. La principale différence entre la valence et le nombre d'oxydation est que la valence est le nombre maximum d'électrons qu'un atome peut perdre, gagner ou partager pour devenir stable tandis que le nombre d'oxydation est le nombre d'électrons qu'un atome peut perdre ou gagner pour former une liaison avec un autre atome.
Référence:
1. «Numéro d'oxydation.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., Disponible ici.
Image gracieuseté:
1. «Période 2 Nombres d'oxydation» par Albris - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


