Différence entre l'oxyde de titane et le dioxyde de titane

Le différence clé entre l'oxyde de titane et le dioxyde de titane est que le L'oxyde de titane contient un anion d'oxygène par un cation en titane tandis que le dioxyde de titane contient deux anions d'oxygène par un cation en titane.
Le titane est un élément chimique ayant le symbole chimique Ti et le numéro atomique 22. C'est un métal brillant qui relève de la catégorie des métaux de transition. En tant que caractéristique majeure, il a une résistance élevée par rapport à sa faible densité. Cet élément peut avoir plusieurs états d'oxydation, mais l'état d'oxydation le plus stable est +4. Il y a plusieurs oxydes qu'il peut former comme l'oxyde de titane (II), l'oxyde de titane (III) et le dioxyde de titane.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'oxyde de titane
3. Qu'est-ce que le dioxyde de titane
4. Comparaison côte à côte - oxyde de titane vs dioxyde de titane sous forme tabulaire
5. Résumé
Qu'est-ce que l'oxyde de titane?
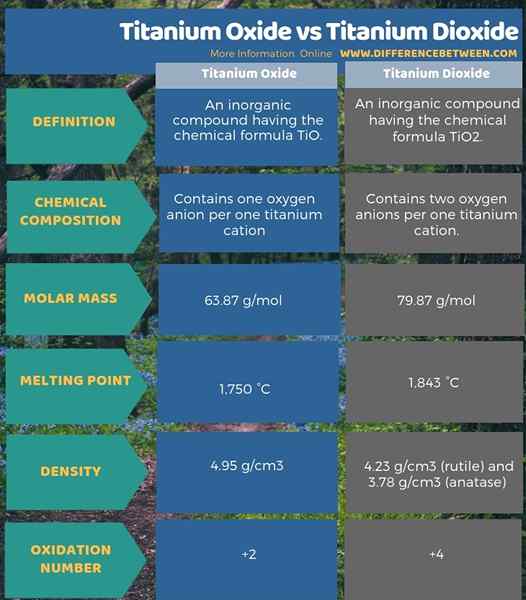
L'oxyde de titane est un composé inorganique ayant la formule chimique tio. Nous nommons ce composé en monoxyde de titane ou en titane (II). La masse molaire de ce composé est 63.87 g / mol. Il apparaît sous forme de cristaux de bronze. De plus, il a un point de fusion élevé qui est de 1750 ° C, et la densité est 4.95 g / cm3. Lorsque vous envisagez la structure cristalline de ce composé, il a une structure cubique.
Nous pouvons préparer ce composé à partir de dioxyde de titane ou également de Titanium Metal. Mais nous devons faire cette réaction à 1500 ° C. En dehors de cela, les solutions acides de ce composé sont stables pendant une courte période, mais plus tard, il se décomposera pour donner de l'hydrogène. Cette réaction est la suivante:
2ti2+(aq) + 2h+(aq) → 2ti3+(aq) + h2(g)
Qu'est-ce que le dioxyde de titane?
Le dioxyde de titane est un composé inorganique ayant la formule chimique tio2. C'est l'oxyde de titane naturel. De plus, nous nommons ce composé sous forme d'oxyde de titane (IV). La masse molaire de ce composé est de 79.87 g / mol. Il apparaît comme un solide blanc. Il a un point de fusion élevé qui est de 1 843 ° C. La densité de ce composé varie selon le type de structure cristalline dans laquelle il existe. Par exemple, la densité de la structure cristalline du rutile est 4.23 g / cm3 tandis que la densité de la structure cristalline de l'anatase est 3.78 g / cm3.

Figure 01: Dioxyde de titane solide blanc
Nous pouvons produire ce composé à partir du traitement du sable de roulement de titane tel que le sable minéral ilménite. Lorsque l'on considère les principales applications de ce composé, elle comprend la production de pigments de dioxyde de titane qui est important pour la production de peintures, de papier, de plastiques, etc.
Quelle est la différence entre l'oxyde de titane et le dioxyde de titane?
L'oxyde de titane est un composé inorganique ayant la formule chimique Tio tandis que le dioxyde de titane est un composé inorganique ayant la formule chimique tio2. Par conséquent, l'oxyde de titane contient un anion d'oxygène par un cation en titane mais le dioxyde de titane contient deux anions d'oxygène par un cation en titane. C'est la principale différence entre l'oxyde de titane et le dioxyde de titane. De plus, en raison de cette structure, ils ont également des masses molaires et différents points de fusion. De plus, le nombre d'oxydation de titane dans chaque composé est différent les uns des autres; Le nombre d'oxydation de titane dans l'oxyde de titane est +2 tandis que le nombre d'oxydation de titane dans le dioxyde de titane est +4. C'est une autre différence importante entre l'oxyde de titane et le dioxyde de titane.
L'infographie ci-dessous tabule la différence entre l'oxyde de titane et le dioxyde de titane plus en détail.
Résumé - Oxyde de titane vs dioxyde de titane
L'oxyde de titane et le dioxyde de titane sont des oxydes importants de l'élément chimique du titane. La principale différence entre l'oxyde de titane et le dioxyde de titane est que l'oxyde de titane contient un anion d'oxygène par un cation en titane mais, le dioxyde de titane contient deux anions d'oxygène par un cation en titane.
Référence:
1. «Oxyde de titane (II).»Wikipedia, Wikimedia Foundation, 19 août. 2018. Disponible ici
2. "Le dioxyde de titane.»Wikipedia, Wikimedia Foundation, 26 août. 2018. Disponible ici
Image gracieuseté:
1.«Oxyde de titane (iv)» par Walkerma à l'anglais Wikipedia. (Domaine public) via Commons Wikimedia


