Différence entre le thiocyanate et l'isothiocyanate
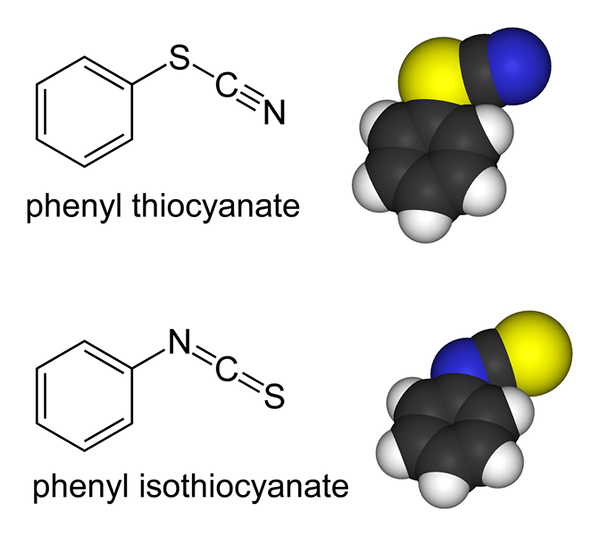
Le différence clé entre le thiocyanate et l'isothiocyanate Le thiocyanate est un groupe fonctionnel dans lequel le groupe alkyle ou aryle est attaché par l'atome de soufre tandis que l'isothiocyanate est l'isomère de liaison du thiocyanate dans lequel le groupe alkyle ou aryle est attaché par l'atome d'azote.
Le thiocyanate et l'isothiocyanate sont des groupes fonctionnels contenant des atomes de carbone, d'azote et de soufre. Ces groupes fonctionnels ont la même connectivité d'atomes. C'est-à-dire que l'atome de carbone est au milieu, tandis que les atomes d'azote et de soufre sont attachés à ses côtés. Cependant, la liaison chimique entre ces atomes est différente les unes des autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le thiocyanate
3. Qu'est-ce que l'isothiocyanate
4. Comparaison côte à côte - thiocyanate vs isothiocyanate sous forme tabulaire
5. Résumé
Qu'est-ce que le thiocyanate?
Le thiocyanate est un anion ayant la formule chimique -SCN-. Il agit comme un groupe fonctionnel dans de nombreux composés organiques. Ici, l'atome de soufre est lié au groupe alkyle ou aryle, tandis que l'atome d'azote est attaché uniquement à l'atome de carbone, qui est au milieu du groupe fonctionnel. Par conséquent, l'atome de soufre a une seule liaison avec l'atome de carbone, tandis que l'atome d'azote a une triple liaison avec l'atome de carbone. L'atome de soufre forme une autre liaison unique avec le groupe alkyle ou aryle lors de la formation du composé organique.

Figure 01: Comparaison entre les groupes fonctionnels du thiocyanate et de l'isothiocyanate dans les composés organiques
L'anion thiocyanate est la base conjuguée de l'acide thiocyanique. Des exemples mieux connus pour les composés contenant cet anion comprennent des composés ioniques, tels que le thiocyanate de potassium et le thiocyanate de sodium. Le phényl thiocyanate est un exemple de composé organique contenant un groupe fonctionnel de thiocyanate. Le groupe thiocyanate est un isomère de liaison du groupe isothiocyanate. Les composés de thiocyanate organiques sont importants car les blocs de construction pour synthétiser les composés organiques contenant du soufre.
Qu'est-ce que l'isothiocyanate?
L'isothiocyanate est l'isomère de liaison du groupe fonctionnel du thiocyanate. Par conséquent, le groupe isothiocyanate contient également des atomes de carbone, d'azote et de soufre.
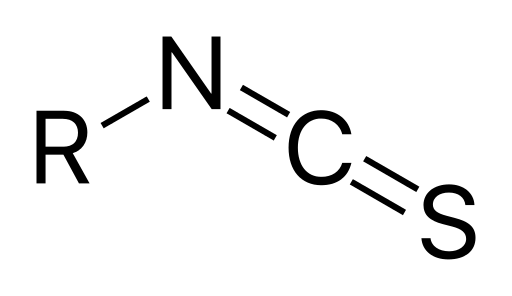
Figure 02: Structure générale du groupe isothiocyanate
Cependant, contrairement au thiocyanate, lors de la formation d'un composé organique, le groupe alkyle ou aryle est lié à ce groupe fonctionnel via l'atome d'azote. Ici, nous pouvons observer une double liaison entre les atomes de carbone et d'azote. Il existe également une double liaison entre les atomes de carbone et de soufre où l'atome de soufre est lié uniquement à l'atome de carbone.
Quelle est la différence entre le thiocyanate et l'isothiocyanate?
Le thiocyanate et l'isothiocyanate sont des isomères; Ce sont des isomères de liaison car ils sont liés aux groupes alkyle ou aryle à différents moments. La principale différence entre le thiocyanate et l'isothiocyanate est qu'un thiocyanate est un groupe fonctionnel dans lequel le groupe alkyle ou aryle s'attache à travers l'atome de soufre, tandis que l'isothiocyanate est l'isomère de liaison du thiocyanate dans lequel le groupe alkyle ou aryle est attaché par l'atomate nitrogen.
De plus, il y a une triple liaison entre les atomes de carbone et d'azote dans le groupe thiocyanate, alors qu'il n'y a pas de triple liaisons entre les atomes de carbone et d'azote dans le groupe isothiocyanate. Par conséquent, nous pouvons observer une seule liaison et une triple liaison entre les atomes du groupe thiocyanate. Il y a deux doubles liaisons entre les atomes du groupe isothiocyanate. En outre, dans le groupe thiocyanate, la géométrie angulaire peut être observée autour de l'atome de soufre tandis que, dans le groupe isothiocyanate, la géométrie angulaire est présente autour de l'atome d'azote.
L'infographie ci-dessous résume la différence entre le thiocyanate et l'isothiocyanate.

Résumé - Thiocyanate vs isothiocyanate
Le thiocyanate et l'isothiocyanate sont des isomères; Ce sont des isomères de liaison car ils sont liés aux groupes alkyle ou aryle à différents moments. La principale différence entre le thiocyanate et l'isothiocyanate est qu'un thiocyanate est un groupe fonctionnel dans lequel le groupe alkyle ou aryle est attaché par l'atome de soufre, tandis que l'isothiocyanate est l'isomère de liaison du thiocyanate dans lequel le groupe alkyl ou aryle est attaché par l'atoma nitrogène.
Référence:
1. «Thiocyanate.»Wikipedia, Wikimedia Foundation, 28 juillet 2019, disponible ici.
2. «Isothiocyanate.»Wikipedia, Wikimedia Foundation, 27 janvier. 2020, disponible ici.
Image gracieuseté:
1. «PHSCN-PHNCS-COMPARISON» (Domaine public) via Commons Wikimedia
2. «Group isothiocyanate» par FvasConcellos - propre travail (domaine public) via Commons Wikimedia


