Différence entre le THF et le dioxane

Le différence clé entre le THF et le dioxane est que Les molécules THF contiennent un atome d'oxygène en tant que membre de la structure de l'anneau alors que la molécule de dioxane contient deux atomes d'oxygène en tant que membres de la structure de l'anneau.
Le THF et le dioxane sont tous deux des solvants organiques qui sont importants pour analyser les échantillons. Ces structures organiques sont des structures cycliques que nous pouvons classer comme des composés hétérocycliques car ces structures de cycle contiennent deux types d'atomes formant l'anneau: atomes de carbone et atomes d'oxygène (s).
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le THF
3. Qu'est-ce que le dioxane
4. Comparaison côte à côte - THF vs dioxane sous forme tabulaire
5. Résumé
Qu'est-ce que le THF?
Le THF est un solvant organique ayant la formule chimique (CH2) 4O. C'est un composé hétérocyclique, et nous pouvons le classer comme un éther car le groupe fonctionnel de la molécule THF est -c-o-c-. Nous pouvons observer le THF comme un liquide organique incolore qui est miscible avec de l'eau. Ce solvant a une odeur semblable à l'éther. Il a également une faible viscosité. Ce solvant est principalement utilisé comme précurseur pour les processus de synthèse des polymères. Le THF est une molécule polaire qui est utile pour la mélanger avec de l'eau. En plus de cela, cette polarité fait de ce.

Figure 01: solvant THF
Lorsque l'on considère les applications du solvant THF, il est important dans les processus de polymérisation; En présence d'acides forts, le THF se transforme en un matériau en polymère linéaire, le poly (éther tétraméthylène) glycol ou ptmeg. Ce matériau en polymère est utile dans la production de fibres de polyuréthane élastomère telles que le spandex.
De plus, le THF est important comme solvant pour le PVC et dans les vernis. En effet, le THF est un solvant aprotique ayant une constante diélectrique de 7.6. Nous pouvons classer le THF comme un solvant modérément polaire qui peut dissoudre une large gamme de composés chimiques non polaires et polaires.
De plus, le THF est utile comme composant de la phase mobile pour la chromatographie liquide en phase inversée. Le THF est utilisé dans cette technique car il a une grande force d'élution que le méthanol ou l'acétonitrile, mais moins couramment utilisé que ces solvants.
Qu'est-ce que le dioxane?
Le dioxane est un composé organique hétérocyclique ayant la formule chimique C4H8O2. Nous pouvons le classer comme un éther où il y a deux groupes-C-O-C- éther. Il existe comme un liquide incolore ayant une odeur légère semblable à l'éther. Il y a trois isomères de dioxane comme 1,2-dioxane, 1,3-dioxane et 1,4-dioxane. Parmi ces trois composés, le 1,4-dioxane est le composé commun où d'autres composés sont rarement rencontrés.
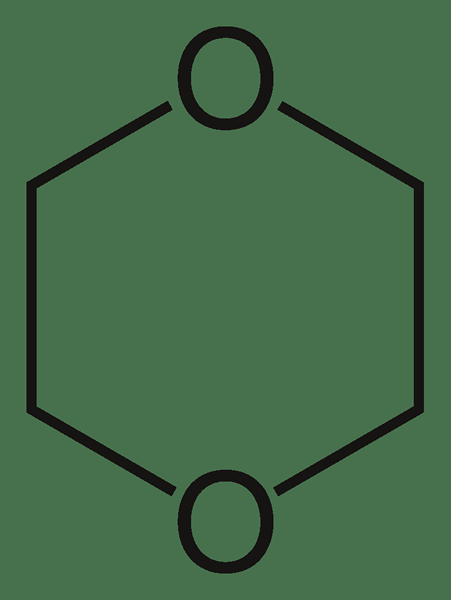
Figure 02: Structure de la molécule de dioxane
Lorsque vous envisagez la synthèse, le dioxane peut être produit via la déshydratation catalysée par l'acide du diéthylène glycol. Nous pouvons obtenir du diéthylène glycol à partir de l'hydrolyse de l'oxyde d'éthylène. Ce liquide est miscible avec de l'eau car il est polaire.
Le dioxane est important dans le transport du trichloroéthane comme stabilisateur. De plus, il est important comme solvant aprotique pour les encres, les adhésifs et les esters de cellulose. Nous pouvons utiliser ce solvant comme substitut de THF dans certains processus en raison de la faible toxicité et du point d'ébullition élevé du solvant de dioxane.
Quelle est la différence entre le THF et le dioxane?
Le THF et le dioxane sont tous deux des solvants organiques qui sont importants pour analyser les échantillons. La principale différence entre le THF et le dioxane est que les molécules THF contiennent un atome d'oxygène en tant que membre de la structure de la bague tandis que la molécule de dioxane contient deux atomes d'oxygène en tant que membres de la structure de l'anneau. Nous pouvons utiliser le dioxane comme substitut du THF en raison d'une faible toxicité et d'un point d'ébullition élevé.
L'infographie ci-dessous montre plus de détails sur la différence entre le THF et le dioxane.

Résumé - THF vs dioxane
Le THF et le dioxane sont tous deux des solvants organiques qui sont importants pour analyser les échantillons. La principale différence entre le THF et le dioxane est que les molécules THF contiennent un atome d'oxygène en tant que membre de la structure de la bague tandis que la molécule de dioxane contient deux atomes d'oxygène en tant que membres de la structure de l'anneau.
Référence:
1. «1,4-dioxane.»Wikipedia, Wikimedia Foundation, 9 septembre. 2020, disponible ici.
Image gracieuseté:
1. «Échantillon de tétrahydrofuran» par Lhchem - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «1-4-dioxane» par Rhododendronbusch - propre travail (domaine public) via Commons Wikimedia


