Différence entre l'acide tartrique et l'acide citrique
Le différence clé entre l'acide tartrique et l'acide citrique est que le acide tartrique (crème tartare, C4H6O6) est diprotique tandis que l'acide citrique (C6H8O7) est triprotique. L'acide tartrique est disponible dans le commerce en poudre blanche et a une très mauvaise solubilité dans l'eau tandis que l'acide citrique est un composé inodore et est disponible sous forme de composé cristallin solide.
L'acide tartrique et l'acide citrique sont des composés acides car leurs groupes carboxyliques peuvent libérer les atomes d'hydrogène en eux à un moyen faisant de la moyenne acide. Ces deux composés sont présents dans les plantes, notamment dans les fruits. L'acide tartrique est présent dans les raisins tandis que l'acide citrique est présent dans les citrons.

CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide tartrique
3. Qu'est-ce que l'acide citrique
4. Comparaison côte à côte - acide tartrique vs acide citrique sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide tartrique?
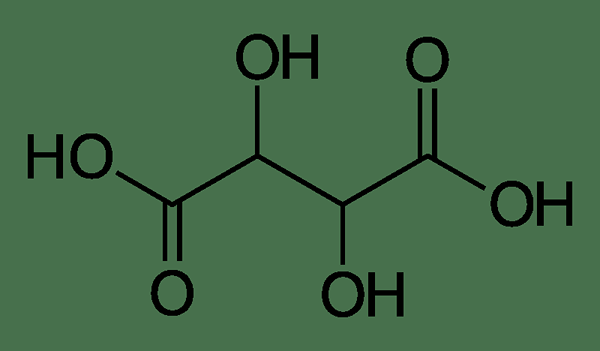
L'acide tartrique, communément appelé crème tartare, est un composé organique ayant la formule chimique C4H6O6. Le nom IUPAC de cet acide est 2,3-dihydroxybutanedioïque acide. La masse molaire de cet acide est 150.08 g / mol et il a une très mauvaise solubilité dans l'eau. Le composé est disponible sous forme de poudre blanche et est irritant sous la forme concentrée.
L'acide tartrique est naturellement disponible en raisins et forme spontanément pendant le processus de vinification à l'aide de raisins. De plus, il est commun dans sa forme de sel de potassium - Bitartrate de potassium. La levure chimique, un agent de levain commun dans la production alimentaire, est un mélange de bicarbonate de sodium et de bitartrate de potassium. De plus, l'acide tartrique fonctionne comme un antioxydant dans certains aliments.
L'acide tartrique est un acide alpha-hydroxy-carboxylique. Cette catégorisation est due aux deux groupes d'acide carboxylique dans cette molécule et ces deux groupes ont un groupe hydroxyle à leur position alpha en carbone. De plus, la molécule est diprotique car il est possible d'éliminer les atomes d'hydrogène dans les deux groupes carboxyliques sous forme de protons.

Figure 1: molécule d'acide tartrique
La molécule d'acide tartrique naturel est un composé chiral. Cela signifie que cette molécule a des éantiomères; il a des énantiomères L et D. L'énantiomère naturel est l'acide tartrique l - (+) -. Ces énantiomères sont optiquement actifs car ils peuvent faire pivoter la lumière polarisée en plan.
Qu'est-ce que l'acide citrique?
L'acide citrique est un composé organique ayant la formule chimique C6H8O7. Le nom IUPAC de ce composé est 2-hydroxypropane-1,2,3-tricarboxylique. Sa masse molaire est de 192.12 g / mol et le point de fusion est de 156 ° C. C'est un composé inodore et est disponible sous forme de composé cristallin solide.
La molécule d'acide citrique a trois groupes d'acide carboxylique, indiquant qu'il est tribasique ou triprotique, mais n'a qu'un seul groupe hydroxyle. L'acide est triprotique car la molécule d'acide peut libérer trois protons par molécule (les trois groupes d'acide carboxyliques peuvent libérer les atomes d'hydrogène en tant que protons).
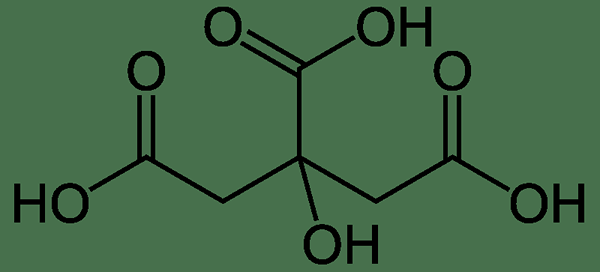
Figure 2: molécule d'acide citrique
L'acide citrique est naturellement disponible dans le citron et d'autres fruits de la famille Rutaceae, je.e., les agrumes. C'est un irritant de la peau et des yeux. Ce composé a différentes applications, telles que les additifs alimentaires, les boissons, l'agent chélatant, l'ingrédient dans certains cosmétiques, etc.
Quelle est la différence entre l'acide tartrique et l'acide citrique?
Acide tartrique vs acide citrique | |
| Acide tartrique est un composé organique ayant la formule chimique C4H6O6. | Acide citrique est un composé organique ayant la formule chimique C6H8O7. |
| Nom IUPAC | |
| 2,3-dihydroxybutanedioïque acide | 2-hydroxypropane-1,2,3-tricarboxylique |
| Masse molaire | |
| 150.08 g / mol | 192.12 g / mol |
| Point de fusion | |
| 206 ° C (dans le mélange racémique d'énantiomères D et L) | 153 ° C |
| Point d'ébullition | |
| 275 ° C | 310 ° C |
| Nombre de groupes d'acides carboxyliques | |
| A deux groupes d'acide carboxylique | A trois groupes d'acide carboxylique |
| Présence d'énantiomères | |
| Deux formes d'énantiomères: acide l-tartrique et acide d-tartrique | Pas d'énantiomères |
| Présence de groupe hydroxyle | |
| A deux groupes hydroxyles | A un groupe hydroxyle |
| Source naturelle | |
| Naturellement disponible en fruits comme les raisins | Disponible en agrumes naturellement |
| Produit commercial | |
| Vendu en bicarbonate de soude | Vendu comme un solide blanc cristallin |
| Applications | |
| Utilisé dans l'industrie pharmaceutique et comme agent chélatant pour le calcium et le magnésium | Utilisé comme ingrédient dans les aliments et les boissons, comme agent chélatant, dans la production de produits pharmaceutiques et de cosmétiques, etc. |
Résumé - acide tartrique vs acide citrique
La principale différence entre l'acide tartrique et l'acide citrique est que l'acide tartrique est diprotique alors que l'acide citrique est triprotique. Cela signifie que la molécule d'acide tartrique a deux atomes d'hydrogène à libérer en tant que protons tandis que la molécule d'acide citrique a trois atomes d'hydrogène à libérer en tant que protons. Ces deux composés acides sont couramment disponibles dans les plantes, notamment chez les fruits; Mais, les raisins sont la source commune d'acide tartrique tandis que les agrumes sont la source commune d'acide citrique.
Référence:
1. "Acide tartrique.»Wikipedia, Wikimedia Foundation, 22 avril. 2018, disponible ici.
2. "Acide citrique.»Wikipedia, Wikimedia Foundation, 17 avril. 2018, disponible ici.
3. Brown, William H. "Acide tartrique.»Encyclopædia Britannica, Inc., 17 avril. 2016, disponible ici.
Image gracieuseté:
1. «Acid tartrique» de Jaga - Auto-fabriqué à l'aide de BKChem et Inkscape (CC BY-SA 3.0) via Commons Wikimedia
2. «Zitronensäure - Citric Acid» par Neurotiker - Propre travaux (domaine public) via Commons Wikimedia


