Différence entre l'état d'équilibre et l'analyse thermique transitoire
Le différence clé entre l'état d'équilibre et l'analyse thermique transitoire est que L'analyse à l'état d'équilibre est effectuée à une température constante tandis que l'analyse thermique transitoire est effectuée à des températures variables.
L'état d'équilibre et l'analyse thermique transitoire sont deux processus qui impliquent l'étude des changements de substances en fonction du temps.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'analyse thermique à l'état d'équilibre
3. Qu'est-ce que l'analyse thermique transitoire
4. Comparaison côte à côte - Analyse thermique transitoire en régime permanent sous forme tabulaire
5. Résumé
Qu'est-ce que l'analyse thermique à l'état d'équilibre?
L'analyse thermique à l'état d'équilibre est l'analyse des changements dans les propriétés d'une substance à une température constante. Premièrement, nous devons comprendre ce qui est un état d'équilibre tel que défini en chimie. L'état d'équilibre est le stade d'une réaction chimique et il a une concentration constante d'un produit intermédiaire. Si une certaine réaction chimique se produit à travers plusieurs étapes (étapes élémentaires), nous pouvons déterminer la vitesse de la réaction en utilisant l'étape de détermination de la vitesse. Et, cette étape est l'étape la plus lente entre autres. Mais, lorsque les étapes de réaction ne sont pas reconnaissables, nous ne pouvons pas reconnaître l'étape la plus lente également. Dans de telles situations, nous pouvons considérer le produit intermédiaire qui a une concentration constante pendant une courte période.

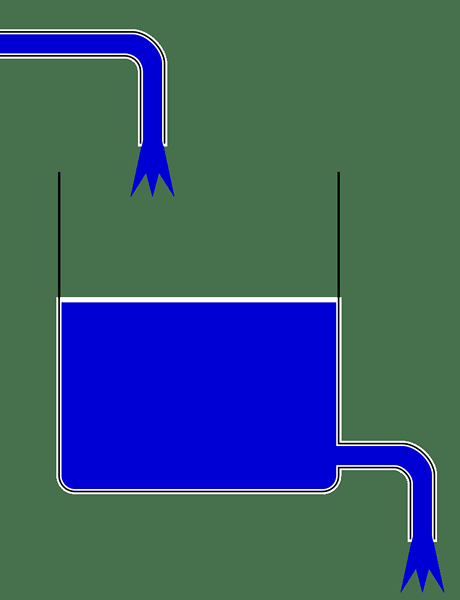
Figure 01: État stationnaire d'un réservoir d'eau; L'eau dans le réservoir intermédiaire est constante
De plus, les étapes élémentaires de la réaction forment des molécules intermédiaires. Les intermédiaires sont des molécules qui ne sont ni réactifs ni produits finaux mais sont des molécules qui se forment pendant la progression d'une réaction chimique. L'intermédiaire de courte durée est formé dans l'état d'équilibre de la réaction. De plus, contrairement à un état d'équilibre, à l'état d'équilibre, les concentrations de réactifs et de produits changent avec le temps (car à l'équilibre, ni la concentration des réactifs ni les changements de produits, ils gardent constant).
Maintenant, revenons à l'analyse thermique à l'état d'équilibre. L'analyse thermique à l'état d'équilibre est la dernière étape de l'analyse thermique transitoire. L'analyse thermique à l'état d'équilibre est importante pour déterminer les températures, les gradients thermiques, les débits de chaleur, les flux de chaleur, etc. dans des objets sur la fourniture de chaleur constante. Les sources de chaleur que nous pouvons utiliser pour l'analyse thermique à l'état d'équilibre comprennent la convection, le rayonnement et les limites de température constantes. De plus, ce type d'analyse donne un graphique linéaire lorsqu'il est dessiné en fonction du temps.
Qu'est-ce que l'analyse thermique transitoire?
L'analyse thermique transitoire est la détermination des changements d'une substance qui se produisent en raison des changements de température calculés sur une période particulière. Cela signifie; Ce type d'analyse traite des températures et d'autres qualités thermiques et leur variation avec le temps. Dans cette technique d'analyse, nous pouvons déterminer les problèmes de traitement thermique, les problèmes associés aux buses, les blocs de moteur, les systèmes de tuyauterie, les récipients de pression, etc. Habituellement, si nous dessinons un graphique en fonction du temps, le graphique est non linéaire.
Quelle est la différence entre l'état d'équilibre et l'analyse thermique transitoire?
L'état d'équilibre et l'analyse thermique transitoire sont deux processus qui impliquent l'étude des changements de substances en fonction du temps. La principale différence entre l'état d'équilibre et l'analyse thermique transitoire est que l'analyse en régime permanent est effectuée à une température constante tandis que l'analyse thermique transitoire est effectuée à une température variable. De plus, si nous exprimons ces détails d'analyse sur les graphiques, l'analyse thermique à l'état d'équilibre donne un graphique linéaire tandis que l'analyse thermique transitoire donne un graphique non linéaire.
L'infographie ci-dessous résume la différence entre l'état d'équilibre et l'analyse thermique transitoire.
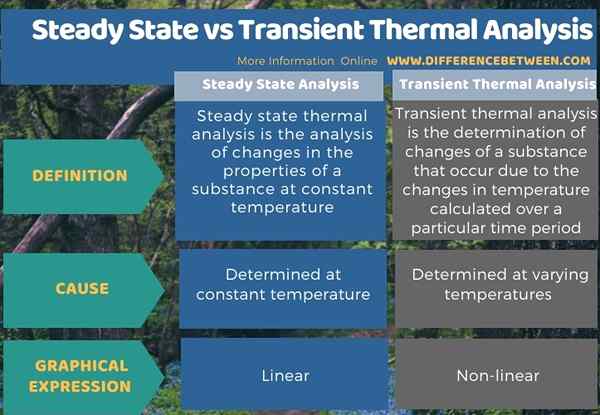
Résumé - Analyse thermique transitoire à l'état d'équilibre vs transitoire
L'état d'équilibre et l'analyse thermique transitoire sont deux processus qui impliquent l'étude des changements de substances en fonction du temps. La principale différence entre l'état d'équilibre et l'analyse thermique transitoire est que l'analyse en régime permanent est effectuée à une température constante tandis que l'analyse thermique transitoire est effectuée à une température variable.
Référence:
1. «Chapitre 3: Analyse thermique transitoire.»Thermal: Chapitre 3: Analyse thermique transitoire (UP19980818), disponible ici.
Image gracieuseté:
1. «Schéma en régime permanent» Von intérieur-Fanatiker - Eigenes Werk (CC BY-SA 3.0) via Commons Wikimedia


