Différence entre constante d'équilibre et constante de vitesse
Le différence clé entre la constante d'équilibre et la constante de vitesse est que le La constante d'équilibre est exprimée en utilisant à la fois les concentrations de réactifs et de produits, tandis que la constante de vitesse est exprimée en utilisant la concentration de réactifs ou de produits.
Les deux, la constante d'équilibre et la constante de vitesse, sont des valeurs constantes pour une réaction particulière. Cela signifie, à une réaction constante, les conditions telles que la température, la valeur de la constante d'équilibre et la constante de vitesse ne changent pas avec le temps. De plus, en exprimant la constante d'équilibre, nous devons également considérer le coefficient stoechiométrique. Mais, pour la constante de taux, nous devons déterminer la valeur en utilisant uniquement une méthode expérimentale.
CONTENU
1. Aperçu et différence clé
2. Quelle est la constante d'équilibre
3. Quelle est la constante constante
4. Comparaison côte à côte - constante d'équilibre vs. Constante de vitesse dans la forme tabulaire
5. Résumé
Quelle est la constante d'équilibre?
La constante d'équilibre est le rapport entre les concentrations de produits et les concentrations de réactifs à l'équilibre. Nous ne pouvons utiliser ce terme qu'avec des réactions qui sont en équilibre. Le quotient de réaction et la constante d'équilibre sont les mêmes pour les réactions qui sont en équilibre.
De plus, nous devons donner cette constante en utilisant les concentrations soulevées au pouvoir des coefficients stoechiométriques. La constante d'équilibre dépend de la température du système car la température affecte la solubilité des composants et l'expansion du volume. Cependant, l'équation de la constante d'équilibre n'inclut aucun détail sur les solides parmi les réactifs ou les produits. Seules les substances de la phase liquide et de la phase gazeuse sont considérées.
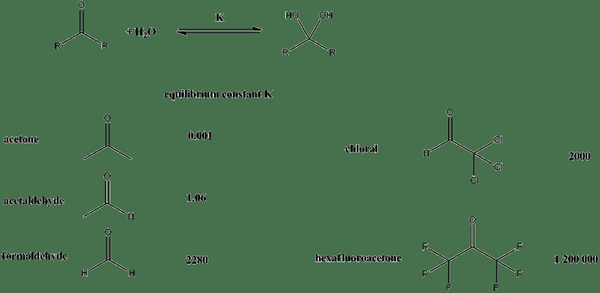
Par exemple, l'équilibre entre l'acide acétique et l'ion acétate est le suivant:
Ch3COOH ⇌ CH3ROUCOULER- + H+
La constante d'équilibre, KC pour cette réaction est la suivante:
Kc = [ch3ROUCOULER-] [H+] / [Ch3COOH]

Figure 01: Constantes d'équilibre pour différents composés
Quelle est la constante constante?
La constante de vitesse est un coefficient de proportionnalité reliant la vitesse d'une réaction chimique à une température donnée à la concentration des réactifs ou des produits de la réaction. Si nous écrivons l'équation de vitesse par rapport au réactif A pour la réaction ci-dessous, c'est comme le suivant.
aa + bb ⟶ cc + dd
R = -k [a] a [b] b
Dans cette réaction, k est la constante de vitesse. C'est une constante de proportionnalité qui dépend de la température. Nous pouvons déterminer la vitesse et la constante de vitesse d'une réaction par des expériences.
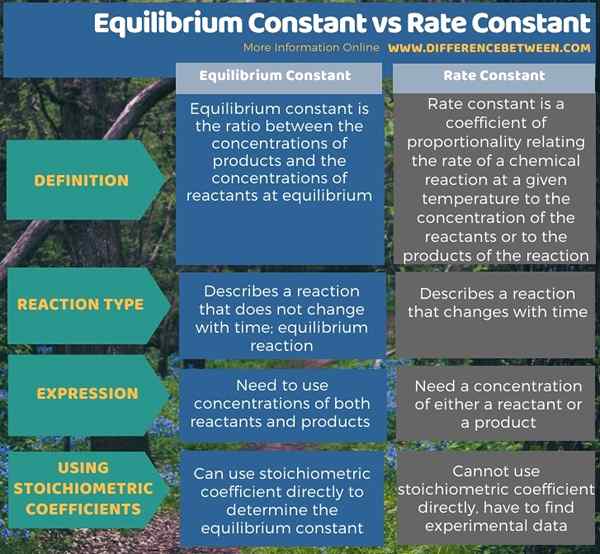
Quelle est la différence entre la constante d'équilibre et la constante de vitesse?
La principale différence entre la constante d'équilibre et la constante de vitesse est que la constante d'équilibre est exprimée en utilisant à la fois les concentrations de réactifs et de produits, tandis que la constante de vitesse est exprimée en utilisant soit la concentration des réactifs ou des produits. De plus, la constante d'équilibre est donnée pour une réaction d'équilibre, tandis que la constante de vitesse peut être donnée pour toute réaction.
De plus, en exprimant la constante d'équilibre, nous pouvons utiliser les concentrations de réactifs et de produits ainsi que les coefficients stoechiométriques tout en exprimant la constante de vitesse, nous ne pouvons pas utiliser le coefficient stoechiométrique car nous devons déterminer la valeur de la constante expérimentalement expérimentale. De plus, la constante d'équilibre décrit un mélange réactionnel inchangé, tandis que la constante de vitesse décrit un mélange réactionnel qui change avec le temps.
Résumé - constante d'équilibre vs. Constante
En résumé, les deux, la constante d'équilibre et la constante de vitesse, ne changent pas avec le temps si les conditions de réaction telles que la température ne sont pas modifiées. Cependant, la principale différence entre la constante d'équilibre et la constante de vitesse est que la constante d'équilibre est exprimée en utilisant à la fois les concentrations de réactifs et de produits, tandis que la constante de vitesse est exprimée en utilisant la concentration de réactifs ou de produits.
Référence:
1. Helmenstine, Anne Marie. «Quelle est la constante constante en chimie?”Thoughtco, sept. 27, 2018, disponible ici.
2. «La constante d'équilibre, k.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
Image gracieuseté:
1. «Hydratks.»Par Nikolavica - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


