Différence entre les réactions spontanées et non spontanées
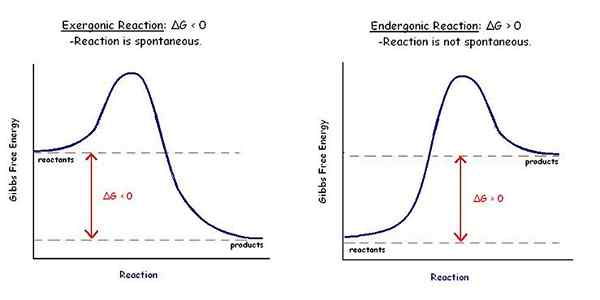
Le différence clé entre les réactions spontanées et non spontanées est que le Les réactions spontanées ont une énergie libre de gibbs négative tandis que les réactions non spontanées ont une énergie libre positive Gibbs.
Les réactions peuvent être des réactions chimiques ou des réactions biologiques. Nous pouvons diviser ces réactions en deux catégories en tant que réactions spontanées et réactions non spontanées. Une réaction spontanée se produit sans aucune influence externe. Mais les réactions non spontanées ne peuvent pas progresser sans une influence externe. Discutons de plus de détails sur ces réactions et tabulons la différence entre les réactions spontanées et non spontanées.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions spontanées
3. Quelles sont les réactions non spontanées
4. Comparaison côte à côte - réactions spontanées vs non spontanées sous forme tabulaire
5. Résumé
Quelles sont les réactions spontanées?
Les réactions spontanées sont des réactions chimiques ou biologiques qui ont lieu sans l'influence d'un facteur externe. De plus, ces réactions favorisent l'augmentation de l'entropie tout en diminuant l'enthalpie d'un système thermodynamique. Étant donné que ces réactions n'ont pas besoin de facteur externe, ils se produisent naturellement. Par conséquent, ces réactions favorisent la formation des produits dans les conditions dans lesquelles la réaction se produit. L'énergie libre gibbs d'une réaction spontanée est une valeur négative.
La plupart des réactions spontanées se produisent rapidement car elle favorise la formation de produits plutôt que de garder le réactif tel qu'il est. Ex: combustion de l'hydrogène. Mais certaines réactions se produisent extrêmement lentement. Ex: Conversion du graphite en diamants. De plus, dans certaines réactions réversibles, une direction de réaction est favorisée dans l'autre direction. Par exemple, dans la formation du dioxyde de carbone et de l'eau de l'acide carbonique, la réaction avant est favorisée; Formation de dioxyde de carbone et d'eau est spontanée.
H2CO3 ↔ CO2 + H2O
Quelles sont les réactions non spontanées?
Les réactions non spontanées sont des réactions chimiques ou biologiques qui ne peuvent pas avoir lieu sans l'influence d'un facteur externe. Par conséquent, ces réactions ne subissent pas dans les conditions naturelles.

Figure 01: Comparaison des réactions spontanées et non spontanées
Ainsi, nous devons fournir un facteur externe à ces réactions à la progression. Ex: Nous pouvons fournir de la chaleur, faire une pression, ajouter un catalyseur, etc. De plus, l'énergie libre de Gibbs est positive pour ces réactions.
Presque toutes les réactions non spontanées sont endothermiques; Ils libèrent de l'énergie à l'extérieur. Ces réactions accompagnent une diminution de l'entropie. Ex: La formation de monoxyde d'azote (pas de gaz) de la réaction entre l'oxygène et l'azote dans notre atmosphère est non spontanée aux conditions normales de température et de pression. Cependant, cette réaction se produit à des températures très élevées.
Quelle est la différence entre les réactions spontanées et non spontanées?
Les réactions spontanées sont des réactions chimiques ou biologiques qui ont lieu sans l'influence d'un facteur externe. Ils favorisent l'augmentation de l'entropie tout en diminuant l'enthalpie d'un système thermodynamique. De plus, l'énergie libre de Gibbs d'une réaction spontanée est une valeur négative. Tandis que les réactions non spontanées sont des réactions chimiques ou biologiques qui ne peuvent pas avoir lieu sans l'influence d'un facteur externe. Ils ne favorisent pas l'entropie croissante ou la diminution de l'enthalpie dans des conditions normales. De plus, l'énergie libre de Gibbs d'une réaction non spontanée est une valeur positive.

Résumé - Réactions spontanées vs non spontanées
Toutes les réactions appartiennent à deux types de réactions telles que les réactions spontanées et les réactions non spontanées. La différence entre les réactions spontanées et non spontanées est que les réactions spontanées ont une énergie libre de gibbs négative tandis que les réactions non spontanées ont une énergie libre positive de Gibbs.
Référence:
1. LibreTexts. «11.5: réactions spontanées et énergie libre.”Chemistry LibreTexts, LibreTexts, 13 juillet 2018. Disponible ici
2. Science, CK12. «Réactions spontanées et non spontanées.»CK-12 Foundation, CK-12 Foundation, 28 mars. 2017. Disponible ici
Image gracieuseté:
1.'Gibbs Free Energy'By Stephjc - Propre travaux, (domaine public) via Commons Wikimedia


