Différence entre SP SP2 et SP3
Le différence clé entre Sp Sp2 et Sp3 est que le Les orbitales hybrides SP ont 50% de caractéristiques orbitales et les orbitales hybrides SP2 ont 33% de caractéristiques orbitales tandis que les orbitales hybrides SP3 ont 25% de caractéristiques orbitales S.
Les termes SP, SP2 et SP3 se réfèrent à différentes hybridations d'orbitales qui conduisent à former des orbitales hybrides. Les orbitales sont des régions hypothétiques autour d'un noyau d'un atome, qui contiennent des électrons de cet atome. Ces orbitales peuvent subir une hybridation afin de former de nouvelles orbitales hybrides qui peuvent former des liaisons chimiques covalentes. Il existe plusieurs formes d'hybridations selon les orbitales atomiques qui participent au processus d'hybridation. SP, SP2 et SP3 sont des hybridations courantes qui impliquent dans les orbitales S et P d'un atome.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que SP
3. Qu'est-ce que SP2
4. Qu'est-ce que SP3
5. Comparaison côte à côte - SP vs SP2 vs SP3 sous forme tabulaire
6. Résumé
Qu'est-ce que SP?
L'hybridation SP est la forme la plus simple de l'hybridation dans laquelle une orbitale S chevauche avec une orbitale p pour former deux nouvelles orbitales SP. Une coque d'électrons contient trois orbitales p. Dans cette hybridation, l'une de ces trois orbitales p se mélange avec une orbitale s du même atome. Par conséquent, il reste deux orbitales p non hybrides dans ces atomes.

Figure 01: Arrangement spatial des orbitales hybrides SP
Le rapport du mélange des deux orbitales atomiques est de 1: 1 (S: P). Par conséquent, la nouvelle orbite hybride a 50% des caractéristiques orbitales S et 50% des caractéristiques orbitales P. Ce mélange des orbitales atomiques S et P forment deux nouvelles orbitales hybrides. Ces deux orbitales s'organisent dans un arrangement spatial linéaire; diriger chaque orbitale atomique vers les directions opposées. Cet arrangement se traduit par la moindre pression entre les deux orbitales. Par conséquent, l'angle de liaison sera de 180◦.
Qu'est-ce que SP2?
L'hybridation SP2 est une forme d'hybridation orbitale dans laquelle une orbite S chevauche avec deux orbitales P pour former trois nouvelles orbitales hybrides. Puisqu'il y a trois orbitales atomiques p dans un atome, cette hybridation laisse une orbitale p non hybride. Contrairement à l'hybridation SP, dans cette forme d'hybridation, la caractéristique S de chaque orbite hybride SP2 est présente à 33% tandis que la caractéristique orbitale p est de 66%.
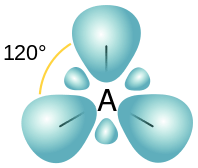
Figure 02: Arrangement spatial des orbitales SP2
Cependant, ce ne sont que des valeurs approximatives car le rapport entre les trois orbitales atomiques implique dans cette hybridation est s: p = 1: 2.
Alors la caractéristique s est égale à 100/3 = 33.33%
Et la caractéristique P est égale (100/3) x 2 = 66.66%
Ces trois nouvelles orbitales hybrides obtiennent la disposition spatiale planaire trigonale afin de minimiser la tension entre les orbitales. De plus, l'angle de liaison entre ces orbitales est de 120◦.
Qu'est-ce que SP3?
L'hybridation SP3 est une forme d'hybridation orbitale dans laquelle une orbite S chevauche avec trois orbitales p. Par conséquent, il n'y a pas d'orbitales P non hybridés car toutes les orbitales p impliquent dans le processus d'hybridation.

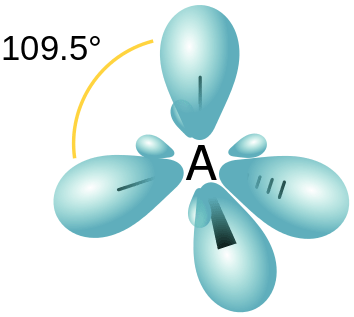
Figure 03: Arrangement spatial des orbitales hybrides SP3
Par conséquent, cela se traduit par 4 nouvelles orbitales hybrides. Étant donné que le rapport entre les orbitales S et P est de 1: 3, la caractéristique S de chaque orbite hybride est de 25% tandis que la caractéristique orbitale p est de 75%. Ces nouvelles orbitales hybrides s'organisent dans un arrangement tétraédrique avec 109.Angle de liaison 5◦.
Quelle est la différence entre SP SP2 et SP3?
L'hybridation SP est la forme la plus simple de l'hybridation dans laquelle une orbite S chevauche une orbitale p pour former deux nouvelles orbitales SP, et une hybridation SP2 est une forme d'hybridation orbitale dans laquelle une orbitale S chevauche deux orbitales p pour former trois nouvelles orbitales hybrides tandis que l'hybridation SP3 est une forme d'hybridation orbitale dans laquelle une orbite S chevauche avec trois orbitales p. C'est la différence fondamentale entre les orbitales hybrides SP SP2 et SP3. De plus, chacune des nouvelles orbitales hybrides qui se forment dans ces trois formes d'hybridations ont des caractéristiques orbitales S différentes car les orbitales S se mélangent avec différents nombres d'orbitales p. Par conséquent, ils ont également des caractéristiques orbitales P.
Cependant, nous pouvons souligner la principale différence entre l'hybridation SP SP2 et SP3 en fonction de la caractéristique S de ces orbitales hybrides; Les orbitales hybrides SP ont 50% de caractéristiques orbitales S, et les orbitales hybrides SP2 ont 33% de caractéristiques orbitales tandis que les orbitales hybrides SP3 ont 25% de caractéristiques orbitales S. De plus, chaque hybridation laisse différents nombres d'orbitales non hybridés. Par exemple, l'hybridation SP n'implique qu'une seule orbitale atomique P. Ainsi, il laisse deux orbitales P atomiques non hybrides.
L'infographie ci-dessous montre une comparaison détaillée côte à côte sur la différence entre l'hybridation SP SP2 et SP3.

Résumé - SP SP2 VS SP3
L'hybridation est un processus dans lequel les orbitales atomiques se mélangent pour former de nouvelles orbitales hybrides qui peuvent subir une liaison chimique covalente. Les formes les plus simples d'hybridations orbitales atomiques sont les hybridations SP, SP2 et SP3. La principale différence entre SP SP2 et SP3 est que les orbitales hybrides SP ont 50% de caractéristiques orbitales et que les orbitales hybrides SP2 ont 33% de caractéristiques orbitales tandis que les orbitales hybrides SP3 ont 25% de caractéristiques orbitales S.
Référence:
1. «Hybridation orbitale.»Wikipedia, Wikimedia Foundation, 13 septembre. 2018. Disponible ici
2. LibreTexts. "Hybridation.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
Image gracieuseté:
1.«AE2H» par JFMelero - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«AE3H» par JFMelero - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
3.«AE4H» par JFMelero - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


