Différence entre l'hypochlorite de sodium et l'acide hypochlouleux
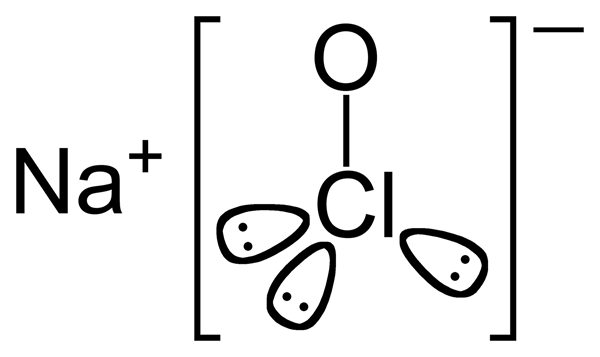
Le différence clé entre l'hypochlorite de sodium et l'acide hypochlouleux est que L'hypochlorite de sodium contient un cation sodium et un anion d'hypochlorite, tandis que l'acide hypochloorel contient un proton et un anion hypochlorite.
L'hypochlorite de sodium et l'acide hypochloreux contiennent des anions en oxydes de chlore. Les deux sont des composés ioniques inorganiques. Dans ces deux composés, les anions sont similaires, mais les cations sont différentes, ce qui les fait avoir des propriétés chimiques et physiques différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hypochlorite de sodium
3. Qu'est-ce que l'acide hypochloreux
4. Similitudes entre l'hypochlorite de sodium et l'acide hypochlouleux
5. Comparaison côte à côte - Hypochlorite de sodium vs acide hypochlore sous forme tabulaire
6. Résumé
Qu'est-ce que l'hypochlorite de sodium?
L'hypochlorite de sodium est un composé ionique inorganique contenant des ions de sodium et d'hypochlorite. La formule chimique de ce composé est naocl. C'est le sel de sodium de l'acide hypochloreux. Habituellement, ce composé est instable, et il peut même se décomposer explosivement. Cependant, sa forme de pentahydrate est stable. La formule chimique de la forme pentahydrate est naocl.5h2o. De plus, la forme hydratée a une couleur jaune verdâtre pâle et se produit comme un solide. Bien que cette forme hydratée soit plus stable que la forme anhydre, nous devons le réfrigérer pour maintenir sa stabilité. De plus, ce composé a une odeur douce et chlore, et sa masse molaire est de 74.44 g / mol.
Figure 01: Structure de l'hypochlorite de sodium
Lorsque vous envisagez les méthodes de préparation, nous pouvons facilement préparer l'hypochlorite de sodium via la réaction entre le sel (NaCl) et l'ozone. C'est une méthode simple, mais elle convient à des fins de recherche. Pour les besoins industriels, ce composé est produit via le processus de talonneur. Dans ce processus, le chlore gaz.
Qu'est-ce que l'acide hypochloreux?
L'acide hypochlouleux est un composé inorganique ayant la formule chimique hocl. C'est un acide faible qui se forme lorsque le chlore gazeux est dissous dans l'eau. Il se produit comme une solution aqueuse incolore. Sa masse molaire est de 52.46 g / mol.
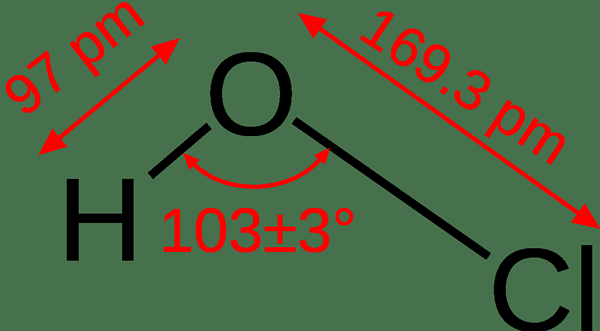
Figure 02: Structure de l'acide hypochloré
Les applications de cet acide faible incluent les suivants:
- En synthèse organique comme intermédiaire
- En tant qu'ingrédient en cosmétiques
- En tant que désinfectant dans les processus de distribution des aliments et de la distribution de l'eau
- Présent dans les neutrophiles et important pour la destruction des bactéries
Quelles sont les similitudes entre l'hypochlorite de sodium et l'acide hypochloré?
- L'hypochlorite de sodium et l'acide hypochloreux contiennent des anions en oxydes de chlore.
- Cet anion est l'hypochlorite anion.
- Les deux sont des composés ioniques inorganiques.
Quelle est la différence entre l'hypochlorite de sodium et l'acide hypochlouleux?
La principale différence entre l'hypochlorite de sodium et l'acide hypochlouleux est que l'hypochlorite de sodium contient un cation sodium et un anion hypochlorite, tandis que l'acide hypochloreux contient un proton et un anion hypochlorite. De plus, l'hypochlorite de sodium apparaît comme un solide vert verdâtre pâle tandis que l'acide hypochloré apparaît comme une solution aqueuse claire. De plus, nous pouvons produire de l'hypochlorite de sodium via le processus de pute ou par la réaction entre le sel et l'ozone; En revanche, nous pouvons produire de l'acide hypochloré par dissolution du chlore gazeux dans l'eau.
Lorsque vous envisagez les utilisations de chaque composé, l'hypochlorite de sodium est utile aux fins de blanchiment, de nettoyage, de désinfection, de désodorisation, etc. Alors que l'acide hypochlouleux est important comme intermédiaire dans les processus de synthèse organique, les ingrédients de l'industrie des cosmétiques, etc.
L'infographie ci-dessous résume la différence entre l'hypochlorite de sodium et l'acide hypochlouleux.
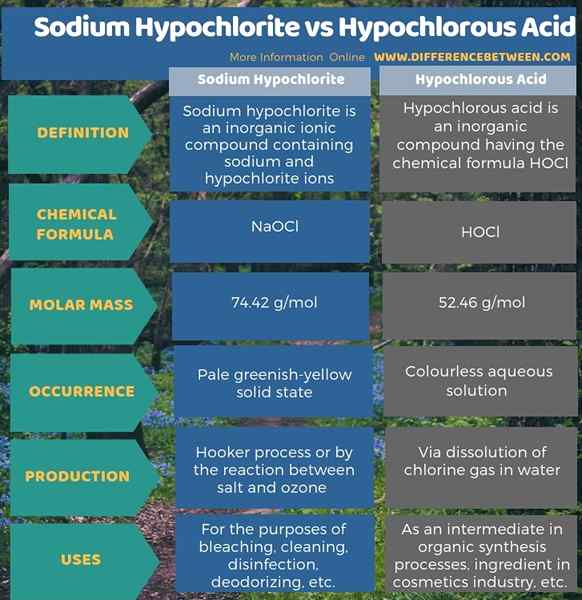
Résumé - Hypochlorite de sodium vs acide hypochlouleux
L'hypochlorite de sodium et l'acide hypochloreux contiennent des anions d'hypochlorite, qui sont des anions en oxydes de chlore. La principale différence entre l'hypochlorite de sodium et l'acide hypochlouleux est que l'hypochlorite de sodium contient un cation sodium et un anion hypochlorite, tandis que l'acide hypochloreux contient un proton et un anion hypochlorite.
Référence:
1. Helmenstine, Anne Marie. «Faits de blanchiment (réponses aux questions courantes).”Thoughtco, sept. 21, 2019, disponible ici.
2. Helmenstine, Anne Marie. «Comment fonctionne de l'eau de Javel?”Thoughtco, sept. 3, 2019, disponible ici.
Image gracieuseté:
1. «Sodium-Hypochlorite» par Benjah-BMM27 - propre travail, domaine public) via Commons Wikimedia
2. «Hypochlore-acid-2d-dimensions» par Liaocyed - propre travail (CC BY-SA 3.0) via Commons Wikimedia


