Différence entre le chlorite de sodium et l'hypochlorite de sodium

Différence clé - chlorite de sodium vs hypochlorite de sodium
Le chlorite de sodium et l'hypochlorite de sodium sont des sels de sodium courants utilisés dans les industries. Ces deux composés sont très importants en tant qu'agents de blanchiment et désinfectants. Mais ils sont très différents les uns des autres lorsque leurs propriétés chimiques telles que la masse molaire et les propriétés physiques sont considérées. Le chlorite de sodium est principalement utilisé dans la fabrication en papier et comme désinfectant. L'hypochlorite de sodium est utilisé comme désinfectant en le dissolvant dans l'eau pour former un «blanchiment liquide». La principale différence entre le chlorite de sodium et l'hypochlorite de sodium est que Le chlorite de sodium contient des atomes de chlore avec +3 état d'oxydation tandis que l'hypochlorite de sodium contient des atomes de chlore avec un état d'oxydation +1.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorite de sodium
3. Qu'est-ce que l'hypochlorite de sodium
4. Similitudes entre le chlorite de sodium et l'hypochlorite de sodium
5. Comparaison côte à côte - chlorite de sodium vs hypochlorite de sodium sous forme tabulaire
6. Résumé
Qu'est-ce que le chlorite de sodium?
Le chlorite de sodium est un composé chimique inorganique ayant la formule chimique naclo2. La masse molaire de ce composé est 90.438 g / mol quand il est anhydre. Il existe également une forme hydrate (composée de trois molécules d'eau associées à la molécule de chlorite de sodium dont la masse molaire est de 144.48 g / mol). Le composé est également appelé acide chlore. C'est un composé ionique qui contient un cation sodium (na+) et l'anion chlorite (CLO2-).

Figure 1: une bouteille remplie de chlorite de sodium
Il est disponible en poudre cristalline blanche qui est inodore. La combustion du chlorite de sodium est difficile, mais elle peut accélérer la combustion de composés organiques. Par conséquent, le chlorite de sodium peut être utilisé pour fabriquer des mélanges explosifs avec des matériaux combustibles. Le chlorite de sodium se décompose à environ 180-200◦C.
Le chlorite de sodium est moins soluble dans l'eau mais plus soluble dans le méthanol et l'éthanol. La structure cristalline du composé est monoclinique. Le chlorite de sodium est principalement utilisé dans la fabrication de papier et aussi comme désinfectant. C'est un bon agent oxydant; est donc utilisé pour blanchir divers types de matériaux tels que le bois, les huiles, etc.
L'acide chloreux libre (HCLO2) est très instable et il n'a pas d'importance considérable dans les industries. Mais le sel de sodium de cet acide est très stable et aussi peu coûteux. La plupart du temps, le chlorite de sodium est dérivé du chlorate de sodium, qui a la formule chimique naclo3. Le processus de production est une méthode indirecte dans laquelle le dioxyde de chlore (CLO2) est produit au début. Le dioxyde de chlore est très explosif et il est fabriqué en réduisant le chlorate de sodium dans un acide fort en présence d'un agent réducteur comme le sulfite de sodium. Le dioxyde de chlore produit est ensuite absorbé par une solution alcaline ainsi qu'une réduction par du peroxyde d'hydrogène (H2O2). Cela donne du chlorite de sodium.
Qu'est-ce que l'hypochlorite de sodium?
L'hypochlorite de sodium est un composé inorganique ayant la formule chimique naclo. Le rapport atomique entre le sodium, le chlore et l'oxygène est de 1: 1: 1. Le composé est composé d'un cation sodium lié à un anion hypochlorite. C'est donc le sel de sodium de l'acide hypochloreux. Lorsque l'hypochlorite de sodium est dissous dans l'eau, il est connu sous le nom de blanchiment liquide en raison de ses propriétés de blanchiment.
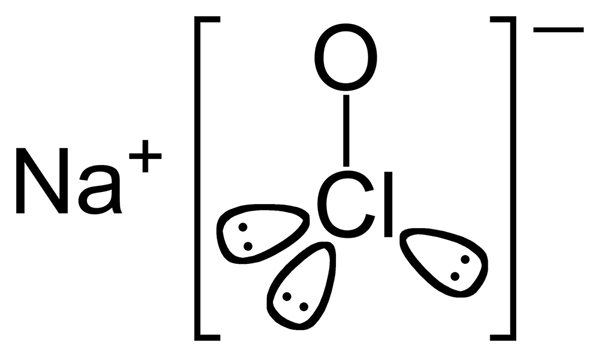
Figure 2: Structure chimique de l'hypochlorite de sodium
La masse molaire d'hypochlorite de sodium est 74.44 g / mol. L'apparition de ce composé peut être décrite comme un solide jaune verdâtre. Il a aussi une odeur douce. Le point de fusion de l'hypochlorite de sodium est de 18 ° C et le point d'ébullition est de 101◦C.
L'hypochlorite de sodium est principalement utilisé comme désinfectant et comme agent de blanchiment. Presque tout le liquide de blanchiment que nous utilisons dans les ménages contiennent environ 3 à 8% d'hypochlorite de sodium. Ce composé a des propriétés de décoration; Il est donc utilisé pour éliminer les taches de moisissure, les taches dentaires, etc. L'hypochlorite de sodium est un bon désinfectant car il a une large gamme d'activité antimicrobienne.
La production d'hypochlorite de sodium se fait via le processus de pute. C'est une méthode industrielle à grande échelle. Ici, l'hypochlorite de sodium est produit en passant du chlore gaz. L'autre produit donné par cette méthode est le chlorure de sodium (NaCl).
Quelles sont les similitudes entre le chlorite de sodium et l'hypochlorite de sodium?
- Le chlorite de sodium et l'hypochlorite de sodium sont composés d'atomes Na, Cl et O.
- Les deux sont de bons désinfectants.
Quelle est la différence entre le chlorite de sodium et l'hypochlorite de sodium?
Chlorite de sodium vs hypochlorite de sodium | |
| Le chlorite de sodium est un composé chimique inorganique ayant la formule chimique naclo2. | L'hypochlorite de sodium est un composé inorganique ayant la formule chimique naclo. |
| Atomicité | |
| Le chlorite de sodium a un atome de sodium, un atome de chlore et deux atomes d'oxygène. | L'hypochlorite de sodium a un atome de sodium, un atome de chlore et un atome d'oxygène. |
| État d'oxydation du chlore | |
| L'état d'oxydation du chlore dans le chlorite de sodium est +3. | L'état d'oxydation du chlore dans l'hypochlorite de sodium est +1. |
| Apparence | |
| Le chlorite de sodium est une poudre cristalline blanche. | L'hypochlorite de sodium est un solide vert verdâtre. |
| Odeur | |
| Le chlorite de sodium est inodore. | L'hypochlorite de sodium a une odeur douce. |
| Masse molaire | |
| La masse molaire de chlorite de sodium est 90.438 g / mol. | La masse molaire d'hypochlorite de sodium est 74.44 g / mol. |
| Point de fusion et point d'ébullition | |
| Le chlorite de sodium se décompose à environ 180-200◦C. | Le point de fusion est de 18 ° C et le point d'ébullition est 101◦C. |
| Composé parent | |
| Le chlorite de sodium est un sel de sodium d'acide chlorant. | L'hypochlorite de sodium est un sel de sodium d'acide hypochloreux. |
| Production | |
| Le chlorite de sodium est produit indirectement à partir du chlorate de sodium. | L'hypochlorite de sodium est produit à partir du processus de pute. |
Résumé - chlorite de sodium vs hypochlorite de sodium
Le chlorite de sodium est naclo2 et l'hypochlorite de sodium est naclo. La principale différence entre le chlorite de sodium et l'hypochlorite de sodium est que le chlorite de sodium contient des atomes de chlore avec un état de +3 oxydations tandis que l'hypochlorite de sodium contient des atomes de chlore ayant +1 oxydations.
Référence:
1. "L'hypochlorite de sodium.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
2. Croswell, Jonathan. «Qu'est-ce que le chlorite de sodium?”Livestrong.Com, groupe de feuilles, 3 octobre. 2017, disponible ici.
3. "L'hypochlorite de sodium.»Wikipedia, Wikimedia Foundation, 17 février. 2018, disponible ici.
Image gracieuseté:
1. «Chlorite de sodium 450G» par w. Oelen - (CC BY-SA 3.0) via Commons Wikimedia
2. «Sodium-Hypochlorite» par Benjah-BMM27 - Propre travaux (domaine public) via Commons Wikimedia


