Différence entre le diagramme de phase et le diagramme d'équilibre
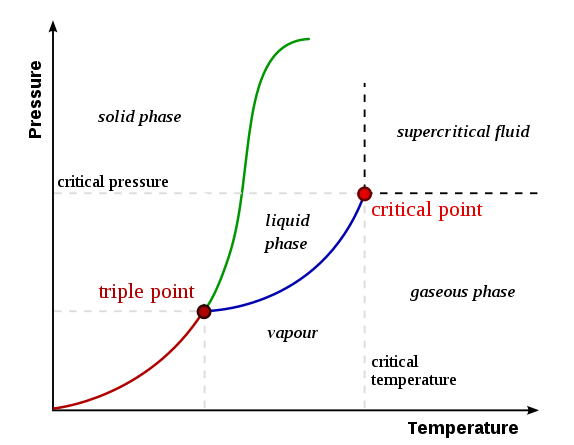
Diagramme clé - Diagramme de phase vs diagramme d'équilibre
Les diagrammes de phase ou les diagrammes d'équilibre sont des graphiques ou des graphiques montrant la relation entre la température, la pression et la composition de tout système. Ces diagrammes donnent des détails sur les conditions des phases thermodynamiquement distinctes qui coexistent en équilibre. Une phase est une partie homogène d'un système qui a des propriétés chimiques et physiques uniformes. Il existe trois phases principales dans lesquelles une substance peut exister: phase solide, liquide et gaz. Il n'y a pas de différence entre le diagramme de phase et le diagramme d'équilibre.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un diagramme de phase
3. Qu'est-ce qu'un diagramme d'équilibre
4. Diagramme de phase vs diagramme d'équilibre
5. Résumé
Qu'est-ce qu'un diagramme de phase?
Un diagramme de phase est un graphique qui résume les détails des conditions des systèmes thermodynamiquement distincts qui coexistent en équilibre entre eux. Un diagramme de phase montre les limites de phase ou les limites d'équilibre qui séparent les phases les unes des autres. Le diagramme de phase est un tracé de pression vs température.

Figure 1: Un diagramme de phase montrant les lignes limites, le point triple et le point critique
Composants importants d'un diagramme de phase
Certains composants importants dans un diagramme de phases comprennent les suites:
- Limites de phase (limites d'équilibre) - Les lignes d'un diagramme de phases qui séparent deux phases; Chaque phase qui est en équilibre avec une autre phase.
- Point triple - un point auquel la ligne d'équilibre se croise. Un triple point indique les conditions d'un système qui a une substance qui peut coexister dans les trois phases de la matière (solide, liquide et gaz).
- Point critique - la température et la pression à laquelle cette substance peut se comporter comme un gaz et un liquide en même temps; des phases de gaz et de liquide indiscernables se produisent. Par conséquent, il n'y a pas de limites de phase. Le point critique est le point final de la courbe de la phase
- Courbe de fusion (Courbes de fusion ou de congélation) - La ligne de limite dans un diagramme de phase qui montre les conditions des transitions de phase entre la phase gazeuse et la phase liquide (ligne de couleur bleue dans le diagramme ci-dessus).
- Courbe de vaporisation (ou courbe de condensation) - la ligne limite dans un diagramme de phase qui montre les conditions des transitions de phase entre la phase solide et la phase liquide (ligne de couleur verte dans le diagramme ci-dessus).
- Courbe de sublimation - La ligne de limite dans un diagramme de phase qui montre les conditions des transitions de phase entre la phase solide et la phase gazeuse (ligne de couleur rouge dans le diagramme de phase ci-dessus).
Ici, la fusion est la fusion ou la congélation qui implique la transition de phase entre la phase gazeuse et la phase liquide. La vaporisation est la conversion d'un liquide en phase de vapeur (phase gazeuse) tandis que la condensation est la conversion d'une vapeur en liquide. La sublimation est la conversion d'un solide en phase gazeuse directement, sans passer par une phase liquide.
Types de schéma de phase
Il existe peu de types de diagrammes de phase.
Diagrammes de phase unary
Ce sont la forme la plus simple des diagrammes de phase. Ces diagrammes montrent les trois phases d'une substance séparées des limites d'équilibre (comme sur la figure 1).
Diagrammes de phase binaire
Un diagramme de phase binaire montre l'équilibre entre deux substances qui existent dans le même système. Dans la plupart des cas, la pression reste la même, et les variables sont la température et les compositions de substances. Ici, les deux substances peuvent être des métaux, un métal et un composé ou deux composés.
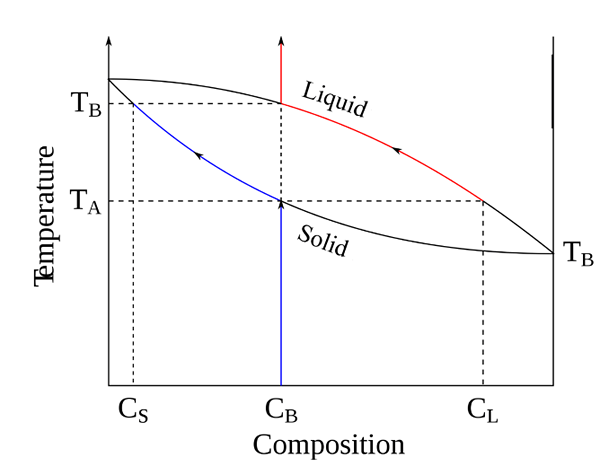
Figure 2: un diagramme de phase binaire
Qu'est-ce qu'un diagramme d'équilibre?
Un diagramme d'équilibre est un graphique qui montre l'équilibre entre les phases d'une substance qui coexistent dans un système fermé. Il est également connu comme un diagramme de phase.
Quelle est la différence entre le diagramme de phase et le diagramme d'équilibre?
- Il n'y a pas de différence entre le diagramme de phase et le diagramme d'équilibre car ce sont des synonymes. Les deux termes se réfèrent au graphique qui résume les détails des conditions des systèmes thermodynamiquement distincts qui coexistent en équilibre entre eux.
Résumé - Diagramme de phase vs diagramme d'équilibre
Une phase est une partie homogène d'un système qui a des propriétés chimiques et physiques uniformes. Il existe trois phases principales que toute substance peut exister: phase solide, phase liquide et phase gazeuse. Un diagramme de phase est un graphique qui représente l'équilibre existe entre différentes phases qui coexistent dans le même système fermé. Ce diagramme est également appelé diagramme d'équilibre car il montre des équilibres.
Référence:
1. «Diagramme d'équilibre.«Le dictionnaire gratuit, Farlex, disponible ici.
2. LibreTexts. «Diagrammes de phase.”Chemistry LibreTexts, LibreTexts, 6 février. 2018, disponible ici.
3. «Liquides.»Diagrammes de phase, chimed.Chem. Disponible ici.
Image gracieuseté:
1. «Phase-diag2» par Matthieumarechal (CC By-Sa 3.0) via Commons Wikimedia [modifié]
2. «Diagramme de phase de fusion partielle» par solidification_1er_cristal.SVG: CDangderivative Work: Fitzgabbro (talk) - solidification_1er_cristal.SVG (CC BY-SA 3.0) via Commons Wikimedia [modifié]


