Différence entre les réactions SN2 et E2
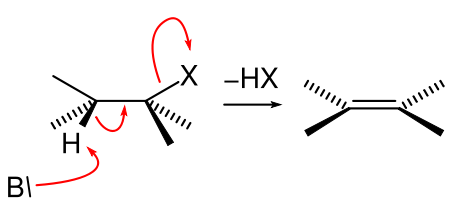
Différence clé - SN2 vs E2 Réactions
Le différence clé entre les réactions SN2 et E2 est que Les réactions SN2 sont des réactions de substitution nucléophile tandis que les réactions E2 sont des réactions d'élimination. Ces réactions sont très importantes en chimie organique car la formation de différents composés organiques est décrite par ces réactions.
Il existe deux types de réactions de substitution nucléophile nommées réactions SN1 et réactions SN2 qui sont différentes les unes des autres en fonction du nombre d'étapes impliquées dans chaque mécanisme. Cependant, ces deux mécanismes incluent la substitution d'un groupe fonctionnel dans un composé organique avec un nucléophile. Il existe deux types de réactions d'élimination nommées comme réactions E1 et E2. Ces réactions donnent le mécanisme d'élimination d'un groupe fonctionnel d'un composé organique.
CONTENU
1. Aperçu et différence clé
2. Que sont les réactions SN2
3. Quelles sont les réactions E2
4. Similitudes entre les réactions SN2 et E2
5. Comparaison côte à côte - SN2 vs réactions E2 sous forme tabulaire
6. Résumé
Que sont les réactions SN2?
Les réactions SN2 sont des réactions de substitution nucléophile qui sont bimoléculaires. Les réactions SN2 sont des réactions en une seule étape. Cela signifie que la rupture des liaisons et la formation de liaisons se produisent à la même étape. La réaction est bimoléculaire car il y a deux molécules impliquées dans l'étape de détermination de la vitesse de la réaction SN2.
Les réactions SN2 ont lieu dans des centres de carbone Aliphatic SP3 avec des groupes de départ stables qui sont attachés à ce centre de carbone. Ces groupes qui laissent sont plus électronégatifs que le carbone. La plupart du temps, le groupe de départ est un atome d'halogénures car les halogénures sont hautement électronégatifs et stables.
Les réactions SN2 ont lieu dans les atomes de carbone substitués primaires et secondaires car l'obstacle stérique empêche les structures tertiaires de passer par le mécanisme SN2. S'il y a des groupes volumineux autour du centre de carbone (qui provoque un obstacle stérique), alors un intermédiaire de carbocation sera formé. Cela conduit à la réaction SN1 plutôt qu'à la réaction SN2.
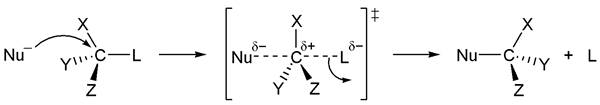
Figure 01: Mécanisme de réaction SN2
La vitesse de la réaction SN2 dépend de divers facteurs; La résistance nucléophile détermine la vitesse de réaction car l'obstacle stérique affecte la force nucléophile. Les solvants utilisés dans la réaction affectent également la vitesse de réaction; Les solvants aprotiques polaires sont préférés pour les réactions SN2. Si le groupe de départ est très stable, il affecte également la vitesse de réaction de SN2.
Quelles sont les réactions E2?
Les réactions E2 sont des réactions d'élimination en chimie organique, qui sont des réactions bimoléculaires. Ces réactions sont appelées réactions bimoléculaires car l'étape de détermination de la vitesse de la réaction implique deux molécules de réactif. Cependant, les réactions E2 sont des réactions en une seule étape. Cela signifie que les formations de rupture et de liaison se produisent à la même étape. En revanche, les réactions E1 sont des réactions en deux étapes.
Il y a un seul état de transition dans les réactions E2. Dans ces réactions, un groupe fonctionnel ou un substituant est retiré d'un composé organique pendant qu'une double liaison se forme. Par conséquent, les réactions E2 provoquent une insaturation des liaisons chimiques saturées. Ce type de réactions se trouve souvent dans les halogénures alkyles. Fondamentalement, les halogénures d'alkyle primaires ainsi que certains halogénures secondaires subissent des réactions E2.
Les réactions E2 se produisent en présence d'une base forte. Ensuite, l'étape de détermination de la vitesse de la réaction E2 comprend à la fois le substrat (composé organique de départ) et la base comme réactifs (cela en fait une réaction bimoléculaire).
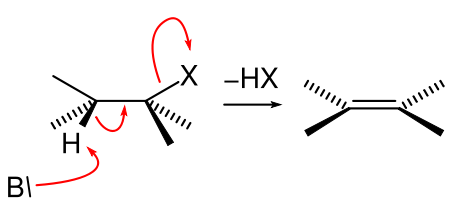
Figure 02: Mécanisme de réaction E2
Les principaux facteurs qui affectent la vitesse de réaction des réactions E2 sont la résistance de la base (la résistance de la base de la base est élevée, la vitesse de réaction est élevée, le type de solvant (les solvants protiques polaires sont préférés), la stabilité du groupe de départ (la stabilité est élevée de quitter le groupe, la vitesse de réaction est élevée), etc.
Quelles sont les similitudes entre les réactions SN2 et E2?
- Les réactions SN2 et E2 sont des réactions bimoléculaires.
- Les deux réactions sont des réactions en une seule étape.
- Les deux réactions sont courantes dans les structures primaires et secondaires des composés organiques.
Quelle est la différence entre les réactions SN2 et E2?
SN2 VS E2 Réactions | |
| Les réactions SN2 sont des réactions de substitution nucléophile qui sont bimoléculaires. | Les réactions E2 sont des réactions d'élimination de la chimie organique qui sont des réactions bimoléculaires. |
| Nature | |
| Les réactions SN2 sont des réactions de substitution. | Les réactions E2 sont des réactions d'élimination. |
| Nucléophile | |
| Les réactions SN2 nécessitent un nucléophile. | La réaction E2 ne nécessite pas de nucléophile. |
| Base | |
| Les réactions SN2 ne nécessitent pas de base essentiellement. | Les réactions E2 nécessitent une base forte. |
| Type de solvant | |
| Les réactions SN2 préfèrent les solvants aprotiques polaires. | Les réactions E2 préfèrent les solvants protiques polaires. |
| Facteurs affectant la vitesse de réaction | |
| La vitesse de réaction SN2 est déterminée par la résistance nucléophile, le type de solvant, la stabilité du groupe de départ, etc. | La vitesse de réaction E2 est déterminée par la force de la base, le type de solvant, la stabilité du groupe de départ, etc. |
Résumé - SN2 VS E2 Réactions
Les réactions SN2 et les réactions E2 sont très courantes en chimie organique. Les réactions SN2 sont des réactions de substitution nucléophile en une seule étape. Les réactions E2 sont des réactions d'élimination en une seule étape, bimoléculaire. La différence entre les réactions SN2 et E2 est que les réactions SN2 sont des réactions de substitution nucléophile tandis que les réactions E2 sont des réactions d'élimination.
Référence:
1.«14.3: Élimination par les mécanismes E1 et E2.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
2.«Réaction SN2.»Wikipedia, Wikimedia Foundation, 11 mars. 2018. Disponible ici
3.«Réaction d'élimination.»Wikipedia, Wikimedia Foundation, 16 mars. 2018. Disponible ici
Image gracieuseté:
1.'SN2 Mécanisme de réaction "par calvero. - Selfmade avec chemdraw., (Domaine public) via Commons Wikimedia
2.'E2-Mechanism' par Matthias M. - Propre travail, (domaine public) via Commons Wikimedia


