Différence entre la page SDS et Western blot
Différence clé - page SDS vs Western blot
Western blot est une technique qui détecte une protéine spécifique d'un échantillon de protéines. Cette technique est effectuée via plusieurs étapes clés: électrophorèse sur gel, buvard et hybridation. Électrophorèse sur gel de polyacrylamide de dodécyl sulfate de sodium (Page SDS) est une sorte de technique d'électrophorèse sur gel qui est utilisée pour séparer les protéines en fonction de leurs tailles (poids moléculaires). Western Blot est une feuille spéciale d'une membrane buvard qui est utilisée pour transférer le même schéma des protéines dans la page SDS. La principale différence entre la page SDS et Western blot est que La page SDS permet la séparation des protéines dans un mélange alors que Western blot permet la détection et la quantification d'une protéine spécifique à partir d'un mélange. Les deux sont utiles dans les études d'analyse des protéines.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la page SDS
3. Qu'est-ce que Western blot
4. Comparaison côte à côte - page SDS vs Western blot
5. Résumé
Qu'est-ce que la page SDS?
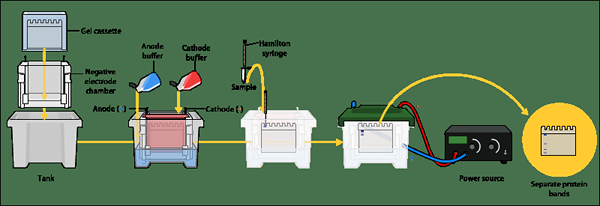
La page SDS est une technique d'électrophorèse sur gel utilisée pour la séparation des protéines. Il est couramment utilisé en biochimie, génétique, en médecine légale et biologie moléculaire. Une fois les protéines extraites de l'échantillon, elles sont exécutées sur un gel composé de SDS et de polyacrylamide. SDS est un détergent anionique qui est utilisé pour linéariser les protéines (protéines dénaturées) et pour transmettre une charge négative aux protéines linéarisées proportionnelles à leur masse moléculaire. Le polyacrylamide devient le soutien solide pour le gel. Les protéines dénaturées qui sont chargées négativement migrent vers l'extrémité positive de l'appareil à travers le gel. Selon les tailles des protéines, les vitesses de migration diffèrent entre les protéines et la séparation se produit. Par conséquent, la page SDS est utile pour la séparation des protéines individuelles en fonction de leurs tailles.
La préparation du gel de polyacrylamide pour le fractionnement des protéines est une étape cruciale dans la page SDS. La concentration correcte de polyacrylamide et le type d'agent de réticulation utilisés affectent fortement les propriétés physiques du gel, ce qui fait la séparation réelle des différentes protéines. La taille des pores du gel doit être correctement gérée pour une séparation efficace. Cependant, la page SDS est considérée comme une technique de séparation des protéines à haute résolution.
La technique de la page SDS a une limitation majeure de l'analyse des protéines. Puisque SDS dénatur les protéines avant la séparation, elle ne permet pas la détection de l'activité enzymatique, les interactions de liaison aux protéines, les cofacteurs protéiques, etc.

Figure 01: page SDS
Qu'est-ce que Western blot?
La technique de Western blot permet la détection d'une protéine spécifique d'un mélange de protéines et une mesure de la quantité et du poids moléculaire de la protéine. Western blot est la membrane utilisée pendant la procédure de transfert pour obtenir l'image miroir des motifs de protéines dans le gel SDS-polyacrylamide. La membrane utilisée pour Western blot est principalement composée de difluorure de nitrocellulose ou de polyvinylidène (PVDF). La membrane avec la protéine transférée peut être utilisée pour identifier la protéine souhaitée. Il nécessite un anticorps de haute qualité pour la détection de la protéine souhaitée par hybridation. L'anticorps se lie à son antigène spécifique et révèle la présence de l'antigène souhaité qui est une protéine.
Le transfert des protéines du gel de polyacrylamide SDS vers le Western blot est effectué par électroblot. Il s'agit d'une méthode efficace et rapide qui fait sortir les électrophoraises des protéines du gel et passer à la membrane de nitrocellulose (Western blot).
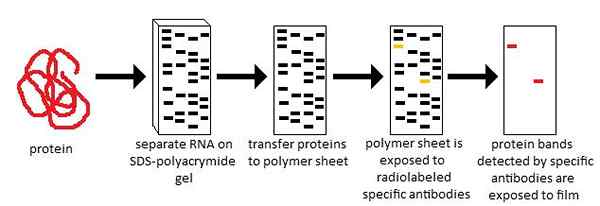
Figure 02: Western blot
Quelle est la différence entre la page SDS et Western blot?
Page SDS vs Western blot | |
| La page SDS est une technique d'électrophorèse sur gel. | Western blot est une technique qui est effectuée sur une membrane pour détecter une protéine spécifique d'un mélange. |
| Utiliser | |
| La page SDS permet la séparation des protéines en fonction de leurs tailles. | Western blot permet le transfert de protéines sur le gel de la page SDS sans modifier son modèle et permet l'hybridation avec des anticorps spécifiques. |
| Désavantages | |
| La dénaturation des protéines, le coût élevé et la présence de produits chimiques de neurotoxine sont les inconvénients de cette technique. | Cette technique prend du temps et nécessite de bonnes conditions contrôlées personnelles et spécifiques expérimentées. |
Résumé - Page SDS vs Western blot
SDS Page et Western blot sont deux méthodes impliquées dans l'analyse des protéines. La page SDS permet une séparation facile des protéines sur un gel en fonction de leur poids moléculaire. Western blot aide à confirmer la présence et la quantité d'une protéine spécifique par l'hybridation avec des anticorps spécifiques. C'est la différence entre la page SDS et Western blot.
Les références:
1. Blancher, C., et un. Jones. «SDS -Page et Techniques Western blot.»Méthodes en médecine moléculaire. U.S. Bibliothèque nationale de médecine, n.d. la toile. 27 mars. 2017
2. Nowakowski, Andrew B., William J. Wobig et David H. Pédale. «SDS-PAGE natif: séparation électrophorétique à haute résolution des protéines avec rétention des propriétés natives, y compris les ions métalliques liés.«Métallomique: science biométale intégrée. U.S. Bibliothèque nationale de médecine, mai 2014. la toile. 27 mars. 2017.
Image gracieuseté:
1. «Electrophorèse SDS-PAGE» par BensAccount à Anglais Wikipedia (CC par 3.0) via Commons Wikimedia
2. «Western blot 114a» par Amanthabagdon - propre travail (domaine public) via Commons Wikimedia


