Différence entre les éléments du bloc S et P
Différence clé - S vs. P Block Elements
Le différence clé Entre les éléments du bloc S et P peuvent être mieux expliqués en utilisant leur configuration électronique. Dans les éléments de bloc S, le dernier électron se remplit de la sous-coquille S et dans les éléments de bloc P, le dernier électron se remplit à la sous-coquille P. Quand ils forment des ions; Les éléments de blocs S retirez leurs électrons de la sous-coque à l'extérieur la plus à l'extérieur facilement tandis que les éléments de bloc P acceptent les électrons vers la sous-coquille P ou retirent les électrons de la subsheille P. Certains éléments du groupe P forment des ions positifs en éliminant les électrons de la sous-shell p plus externe et certains éléments (les éléments les plus électronégatifs) forment des ions négatifs acceptant un électron de d'autres. Lorsque vous considérez les propriétés chimiques, il existe une différence significative entre les éléments du bloc S et P; Cela est essentiellement dû à la configuration d'électrons.
Quels sont les éléments S-Block?
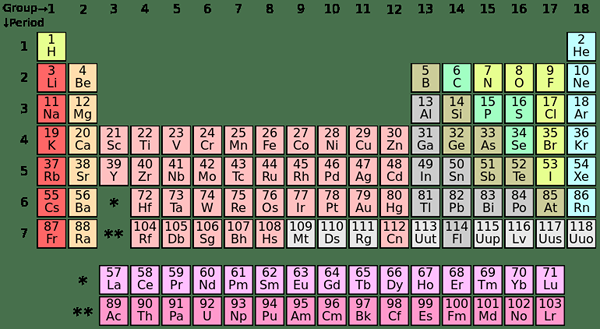
Les éléments S-Block sont les éléments chimiques du groupe I et du groupe II dans le tableau périodique. Étant donné que la sous-coquille S ne peut accueillir que deux électrons, ces éléments ont généralement un (groupe I) ou deux électrons (groupe II) dans la coquille la plus externe. Les éléments des groupes I et II sont indiqués ci-dessus dans le tableau.
| Ia | II A | |
| 2 | Li | Être |
| 3 | N / A | Mg |
| 4 | K | Californie |
| 5 | RB | SR |
| 6 | CS | Ba |
| 7 | Frousser | Rampe |
| Ia | Métaux alcalins |
| II A | Métaux alcalino-terreux |
Tous les éléments en s-blocs forment des ions positifs et ils sont très réactifs.

Le placement des éléments S-Block dans le tableau périodique
Quels sont les éléments P-Block?
Les éléments P-Block sont les éléments dont le dernier électron se remplit dans les sous-coquilles P. Il y a trois orbitales P; Chaque orbitale peut accueillir deux électrons, ce qui fait le total de six électrons p. Par conséquent, les éléments P-Block ont un à six électrons P dans leur coque à l'extérieur. Le bloc P contient à la fois des métaux et des non-métaux; De plus, il y a aussi des métalloïdes.
| 13 | 14 | 15 | 16 | 17 | 18 | |
| 2 | B | C | N | O | F | Ne |
| 3 | Al | Si | P | S | CL | Ardente |
| 4 | Géorgie | Ge | Comme | SE | BR | Krot |
| 5 | Dans | Sn | Sb | Te | je | Xe |
| 6 | Tl | PB | Bi | Pote | À | Infirmier |
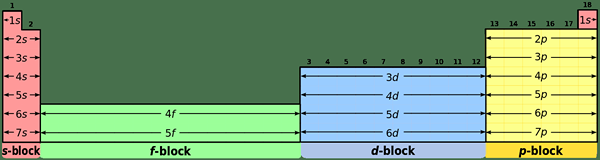
Quelle est la différence entre les éléments du bloc S et P?
Configuration d'électrons commune:
Éléments de blocs S: Les éléments S-Block ont la configuration d'électrons commune de [Noble Gas] ns1 (pour les éléments du groupe I) et [gaz noble] ns2 (pour les éléments du groupe II).
Éléments de bloc P: Les éléments de bloc P ont la configuration d'électrons commune de [Noble Gas] ns2 NP1-6. Mais, l'hélium a 12 configuration; C'est une situation spéciale.
États d'oxydation:
Éléments de blocs S: Les éléments S-Block ne montrent pas plusieurs états d'oxydation comme les éléments P-Block. Par exemple, les éléments du groupe I montrent +1 l'état d'oxydation et les éléments du groupe II montrent un état d'oxydation +2.
Éléments de bloc P: Contrairement aux éléments S-Block, les éléments P-Block ont un état d'oxydation commun pour leur groupe respectif dans le tableau périodique et certains autres états d'oxydation supplémentaires en fonction de la stabilité de l'ion.
| Groupe | 13 | 14 | 15 | 16 | 17 | 18 |
| Configuration d'électrons généraux | ns2NP1 | ns2NP2 | ns2NP3 | ns2NP4 | ns2NP5 | ns2NP6 |
| 1St membre du groupe | Être | C | N | O | F | Il |
| Numéro d'oxydation commun | +3 | +4 | +5 | -2 | -1 | 0 |
| Autres états d'oxydation | +1 | +2, -4 | +3, -3 | +4, +2, | +3, + 5, +1, +7 | - |
Propriétés:
Éléments de blocs S: En général, tous les éléments S-Block sont des métaux. Ils sont brillants, de bons conducteurs électriques et de chaleur et les électrons faciles à retirer de la coque de valence. Ce sont les éléments les plus réactifs du tableau périodique.
Éléments de bloc P: La plupart des éléments de bloc P sont des non-métaux. Ils ont des points d'ébullition faibles, de mauvais conducteurs et difficile à retirer les électrons de la coque la plus externe. Au lieu de cela, ils gagnent des électrons. Certains des non-métaux sont des solides (C, P, S, SE) à température ambiante tandis que certains sont des gaz (oxygène, azote). Le brome est un non-métal, et c'est un liquide à température ambiante.
De plus, le bloc P contient certains éléments métalliques; L'aluminium (AL), le gallium (GA), l'indium (in), l'étain (SN), le thallium (TL), le plomb (PB) et le bismuth (BI).
Image gracieuseté:
1. «Tableau périodique (polyatomique)» par DePiep [CC BY-SA 3.0] via les communes
2. «La table périodique bloque SPDF (32 colonnes)» par l'utilisateur: Depiep [CC BY-SA 3.0] via les communes


