Différence entre les réactions redox et non redox

Le différence clé entre les réactions redox et non redox Dans les réactions redox, l'état d'oxydation de certains éléments chimiques passe d'un état à un autre état alors que, dans les réactions non redoxes, les états d'oxydation des éléments chimiques ne changent pas.
Les réactions redox et non redox sont deux principaux types de réactions chimiques. Ces deux groupes diffèrent les uns des autres en fonction des changements qui se produisent aux états d'oxydation des éléments chimiques à partir desquels les réactifs sont faits de.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions redox
3. Quelles sont les réactions non révisées
4. Comparaison côte à côte - réactions redox vs non redox sous forme tabulaire
5. Résumé
Quelles sont les réactions redox?
La réaction redox est un type de réaction chimique dans laquelle l'oxydation et la réduction des demi-réactions se produisent simultanément. Dans cette réaction, nous considérons l'oxydation et la réduction comme des processus complémentaires. Ici, l'oxydation est la perte d'électrons ou l'augmentation de l'état d'oxydation tandis que la réduction est le gain d'électrons ou la diminution de l'état d'oxydation. Le terme «redox» est une forme courte des processus de réduction-oxydation.
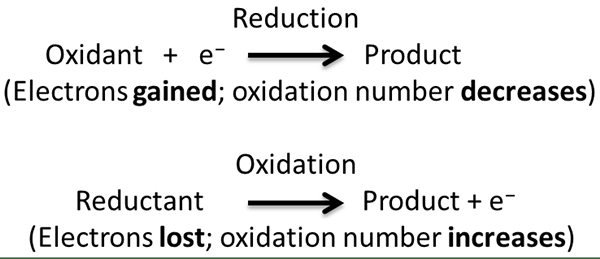
Au cours d'une réaction redox, le composé chimique / réactif qui subit la réduction est appelé l'agent oxydant tandis que le composé qui subit une oxydation est appelé l'agent réducteur. En effet.
Dans une réaction redox, ce qui se passe réellement, c'est le transfert d'électrons entre deux réactifs à une demi-réaction. Nous pouvons facilement identifier ce transfert d'électrons en observant les états d'oxydation des éléments chimiques. Pendant le transfert d'électrons, l'état d'oxydation augmente si les électrons sont perdus car il laisse des protons déséquilibrés dans les atomes, et l'état d'oxydation diminue lorsque les électrons sont gagnés parce que les électrons sont des charges négatives de particules subatomiques. Il existe différents types de réactions redox, telles que les réactions de décomposition, les réactions combinées, les réactions de déplacement et les réactions de disproportionnement.
Quelles sont les réactions non révisées?
Les réactions nonredox sont des réactions chimiques où aucun changement dans les états d'oxydation des éléments chimiques ne se produisent. Par conséquent, ces réactions chimiques n'ont pas de demi-réaction pour l'oxydation et la réduction comme dans les réactions redox. En d'autres termes, des transferts d'électrons se produisent pendant la progression de la réaction chimique.

Figure 02: Réaction de neutralisation de NaOH et HCl
Des exemples courants de réactions non redoxes comprennent les réactions de neutralisation et les réactions à double déplacement.
Quelle est la différence entre les réactions redox et non redox?
Les réactions redox et non redox sont deux types différents de réactions chimiques. La principale différence entre les réactions redox et non redox est que dans les réactions redox, l'état d'oxydation de certains éléments chimiques passe d'un état à un autre état alors que, dans les réactions non redoxes, les états d'oxydation des éléments chimiques ne changent pas. De plus, les réactions redox ont une demi-réaction d'oxydation et une demi-réaction de réduction tandis qu'aucune demi-réaction particulière ne peut être observée dans les réactions non redox. Réactions de décomposition, réactions de déplacement, réactions de disproportionnement, etc. sont des exemples de réactions redox pendant les réactions de neutralisation, les réactions à double déplacement, etc. sont des exemples de réactions non redox.
L'infographie suivante tabule les différences entre les réactions redox et non redox.

Résumé - Redox vs réactions non redoxes
Les réactions redox et non redox sont deux types différents de réactions chimiques. La principale différence entre les réactions redox et non redox est que dans les réactions redox, l'état d'oxydation de certains éléments chimiques passe d'un état à un autre état alors que, dans les réactions non redoxes, les états d'oxydation des éléments chimiques ne changent pas.
Référence:
1. «Réactions d'oxydation-réduction." Chemistry LibreTexts, LibreTexts, 15 août. 2020, disponible ici.
Image gracieuseté:
1. «Redox Halves» par Cameron Garnham - Propre travaux (CC By-SA 3.0) via Commons Wikimedia
2. «Réaction de neutralisation entre l'hydroxyde de sodium et l'acide chlorhydrique» par bluescan sv.Wiki - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


