Différence entre la protonation et l'ionisation
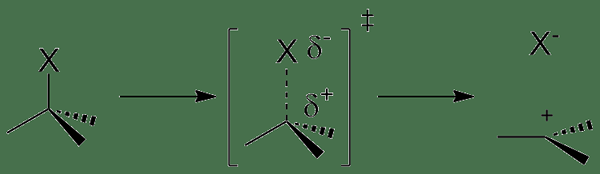
Le différence clé entre la protonation et l'ionisation est que La protonation est l'ajout d'un proton à une espèce chimique, tandis que l'ionisation est l'élimination ou l'obtention d'électrons d'espèces chimiques.
La protonation et l'ionisation sont deux concepts chimiques qui sont importants pour décrire le comportement ionique des espèces chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la protonation
3. Qu'est-ce que l'ionisation
4. Comparaison côte à côte - protonation vs ionisation sous forme tabulaire
5. Résumé
Qu'est-ce que la protonation?
La protonation est l'ajout d'un proton à une espèce chimique telle qu'un atome, une molécule ou un ion. Cela forme l'acide conjugué des espèces chimiques correspondantes. La protonation peut être décrite comme une réaction chimique fondamentale, et c'est une étape importante dans de nombreux processus stoechiométriques et catalytiques.
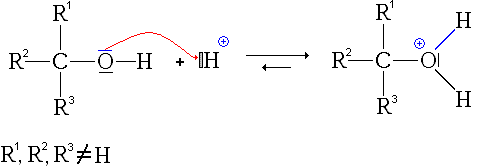
Figure 01: une réaction de protonation
Il existe deux types de processus de protonation appelés protonation monobasique et protonation polybasique. Protonation monobasique est la protonation unique qui se déroule dans certains ions et molécules. Mais dans certains ions et molécules, il peut y avoir plus d'une protonation, et nous pouvons les nommer en tant qu'espèces chimiques polybasiques. Cette nature polybasique c'est vrai pour de nombreuses macromolécules biologiques.
Qu'est-ce que l'ionisation?
L'ionisation est un processus chimique dans lequel les atomes ou les molécules obtiennent une charge positive ou négative. Ce processus se produit en raison de l'élimination ou de l'obtention d'électrons à partir d'atomes ou de molécules, respectivement. Dans le processus d'ionisation, nous pouvons nommer les ions résultants en tant qu'anions et cations, selon la charge qu'ils ont, je.e. Les cations sont des ions chargés positivement et les anions sont des ions chargés négativement. Fondamentalement, la perte d'électrons d'un atome neutre ou d'une molécule forme un cation, et le gain d'électrons d'un atome neutre lui donne une charge négative, formant un anion.
Lorsqu'un électron est retiré d'un atome gazeux neutre par l'ajout d'énergie, il forme un cation monovalent. En effet, un atome neutre a un nombre égal d'électrons et de protons, ce qui n'a donné aucune charge nette; Lorsque nous retirons un électron de cet atome, il y a un excès de proton qui n'a pas d'électron pour neutraliser sa charge. Par conséquent, cet atome obtient une charge de +1 (c'est la charge du proton). La quantité d'énergie requise pour cela est la première énergie d'ionisation de cet atome.
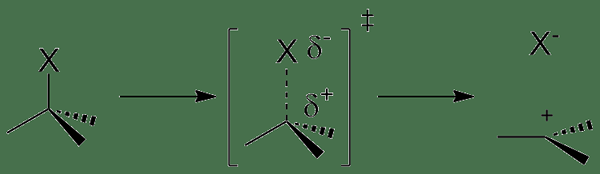
Figure 02: réaction d'ionisation
En outre, l'ionisation qui se déroule dans une solution liquide est la formation d'ions dans la solution. Par exemple, lorsque les molécules HCL se dissolvent dans l'eau, les ions hydronium (H3O +) sont formés. Ici, le HCL réagit avec les molécules d'eau et forme des ions hydronium chargés positivement et du chlorure chargé négativement (CL-) ions.
De plus, l'ionisation peut se produire par des collisions. Mais ce type d'ionisation se produit principalement dans les gaz lorsqu'un courant électrique passe par le gaz. Si les électrons du courant ont une quantité suffisante d'énergie nécessaire pour éliminer les électrons des molécules de gaz, elles forceront les électrons des molécules de gaz, produisant des paires d'ions qui se composent de l'ion positif individuel et de l'électron négatif. Ici, les ions négatifs se forment également parce que certains électrons ont tendance à se fixer aux molécules de gaz plutôt que de retirer les électrons.
De plus, l'ionisation se produit lorsque le rayonnement énergétique ou les particules chargées suffisamment énergiques passent à travers des solides, des liquides ou des gaz; Par exemple, les particules alpha, les particules bêta et le rayonnement gamma peuvent ioniser des substances; Par conséquent, nous leur nommons un rayonnement ionisant.
Quelle est la différence entre la protonation et l'ionisation?
La protonation et l'ionisation sont des concepts chimiques importants en chimie. La principale différence entre la protonation et l'ionisation est que la protonation est l'ajout d'un proton à une espèce chimique, tandis que l'ionisation est l'élimination ou l'obtention d'électrons d'espèces chimiques.
L'infographie ci-dessous résume les différences entre la protonation et l'ionisation sous forme tabulaire.
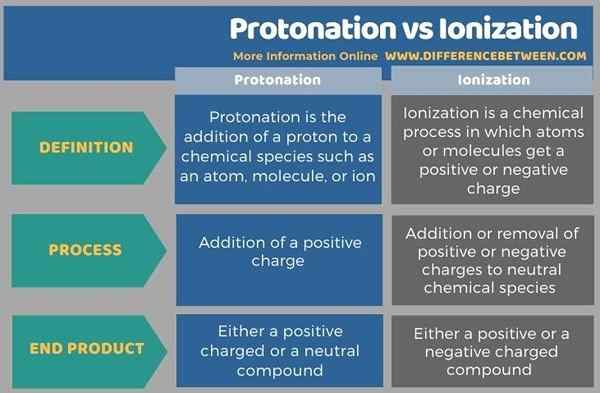
Résumé - Protonation vs ionisation
La protonation et l'ionisation sont opposées les unes aux autres car la protonation fait référence à l'addition tandis que l'ionisation se réfère principalement à la rupture des liaisons. La principale différence entre la protonation et l'ionisation est que la protonation est l'ajout d'un proton à une espèce chimique, tandis que l'ionisation est l'élimination ou l'obtention d'électrons d'espèces chimiques.
Référence:
1. «L'ionisation." Encyclopædia Britannica, Encyclopædia Britannica, Inc., Disponible ici.
Image gracieuseté:
1. «Protonation d'Unt Alcool Teraire» par le versement d'origine était Rhadamante à Wikipedia française. - Transféré de FR.Wikipedia à Commons par Bloody-Libu en utilisant CommonShelper. (CC BY-SA 3.0) via Commons Wikimedia
2. «Réaction d'ionisation» par Cseizert - propre travail (CC By-SA 3.0) via Commons Wikimedia


