Différence entre protéase et protéinase
Différence clé - Protease vs Proteinase
Les protéines sont composées de monomères d'acide aminé en carbone, hydrogène, oxygène et azote. Ce sont des macromolécules et sont structurellement disposés en différents niveaux. Les protéines jouent un rôle important dans les propriétés structurelles et fonctionnelles du corps. La protéine est un nutriment essentiel et peut être obtenue à partir de sources alimentaires animales et végétales. La digestion des protéines commence dans l'estomac et se termine dans l'intestin grêle où il est absorbé et transporté vers des organes cibles. La dégradation des protéines est également un processus vital dans de nombreuses industries, notamment l'industrie du cuir, l'industrie de la laine, l'industrie alimentaire et les techniques de génie génétique. La dégradation des protéines ou la protéolyse est une réaction catalysée par enzyme qui se déroule avec l'implication d'un type enzymatique spécialisé appelé hydrolases. La protéase et les protéinases sont deux de ces hydrolases impliquées dans la dégradation des protéines. Les protéases sont impliquées dans le clivage de la liaison peptidique dans les protéines, provoquant la dégradation des protéines. Les protéinases sont un type de protéase qui est capable de cliver les liaisons peptidiques internes. C'est la principale différence entre la protéase et la protéinase.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la protéase
3. Qu'est-ce que la protéinase
4. Similitudes entre la protéase et la protéinase
5. Comparaison côte à côte - protéase vs protéinase sous forme tabulaire
6. Résumé
Qu'est-ce que la protéase?
Les protéases appartiennent à la classe de la Commission enzymatique numéro 3 (EC3). C'est un type d'hydrolase et participe à une réaction nucléophile avec le substrat. L'enzyme de protéase active un nucléophile qui attaquera le carbone de la liaison peptidique. Cette attaque nucléophile entraînera la formation d'un composé intermédiaire de haute énergie qui reviendra rapidement à la stabilité par dégradation. Cela entraînera le clivage à la liaison peptidique, entraînant deux fragments de peptides. Il existe quatre principaux types de protéases: les protéases aspartiques, les protéases de cystéine, les protéases aspartyl et les métalloprotéases. La méthode d'attaque nucléophile diffère dans chaque classe enzymatique.
Les protéases sont utilisées dans des conditions naturelles dans la digestion des protéines et dans des conditions industrielles pour produire des produits commerciaux. Les protéases sont en outre divisés sous forme d'exopeptidases et endopeptidases.

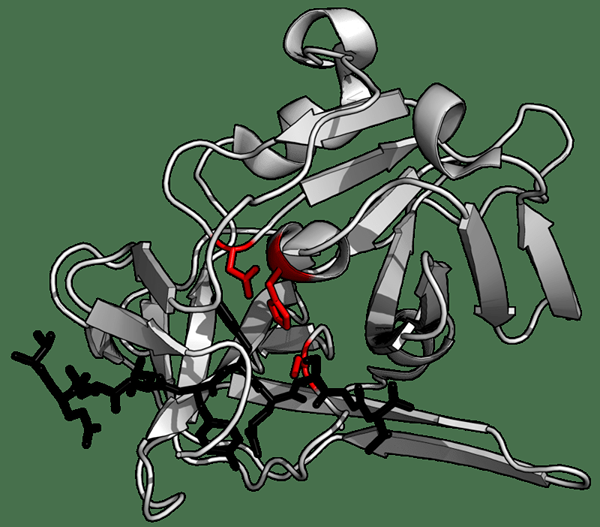
Figure 01: Structure de protéase
Industriellement, les protéases sont principalement utilisées dans l'industrie du cuir et de l'alimentation. À l'heure actuelle, les protéases sont utilisées dans la production commerciale de nombreuses enzymes et autres industries de production de protéines. Ils sont également utilisés dans le domaine de la biotechnologie pour faciliter les méthodes de génie génétique.
Qu'est-ce que la protéinase?
La protéinase est un type de protéase. L'action de la protéinase est similaire à une protéase, et elle agit comme une hydrolase. La protéinase est une endo-peptidase et participe au clivage des liaisons peptidiques internes des longues chaînes de peptides. Ceux-ci peuvent également être des liaisons intra-peptidiques des protéines complexes.
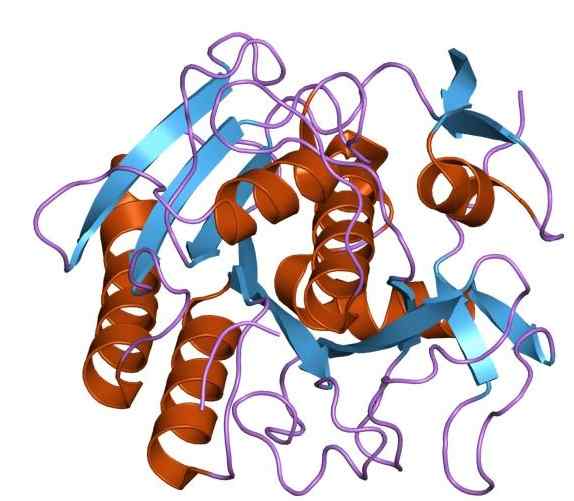
Figure 02: Structure de la protéinase K
Les protéinases sont également importantes dans les fonctions physiologiques normales et à des fins industrielles.
Quelles sont les similitudes entre la protéase et la protéinase?
- Les deux sont des hydrolases.
- Les deux agissent comme des enzymes protéolytiques.
- La technologie d'ADN recombinante est actuellement utilisée pour produire les deux enzymes.
- Les deux enzymes clivent la liaison peptidique des protéines et des protéines dégradantes.
- Les deux enzymes sont utilisées dans les industries - l'industrie du cuir, l'industrie de la laine, l'industrie alimentaire et la technologie ADN recombinante et la protéomique.
- En physiologie, les protéases et les protéinases sont utilisées dans la digestion
Quelle est la différence entre la protéase et la protéinase?
Protéase vs protéinase | |
| Les protéases sont les enzymes qui clivent la liaison peptidique dans les protéines. | Les protéinases sont un type de protéase qui est capable de cligner des liaisons peptidiques internes. |
| Action | |
| Les protéases peuvent être des endo- peptidases ou des exo-peptidases. | Les protéinases sont des endo-peptidases. |
Résumé - Protease vs protéinase
Les protéases et les protéinases sont des hydrolases protéolytiques qui sont utilisées et fabriquées commercialement à diverses fins. Les protéases sont les enzymes qui clivent la liaison peptidique dans les protéines. Les protéinases sont un type de protéase qui clive les liaisons peptidiques internes. C'est la différence fondamentale entre les protéases et les protéinases.
Télécharger la version PDF de Protease vs Proteinase
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici différence entre protéase et protéinase
Les références:
1. Mótyán, Jánosandrás, et al. «Applications de recherche des enzymes protéolytiques en biologie moléculaire.”Biomolecules, MDPI, DEC. 2013, disponible ici. Consulté le 15 septembre. 2017.
2. «Biochimie structurelle / mécanisme catalytique enzymatique / protéases.«Biochimie structurelle / enzyme Mécanisme catalytique / protéases - WikiBooks, disponible ici. Consulté le 15 septembre. 2017.
Image gracieuseté:
1. «TEV Protease Résumé» par Thomas Shafee - Thomas, Shafee, (2014). «Evolubilité d'une protéase virale: évolution expérimentale de la catalyse, de la robustesse et de la spécificité». Thèse de doctorat. Université de Cambridge (CC par 4.0) via Commons Wikimedia
2. «PDB 1pek ebi» par Jawahar Swaminathan et le personnel MSD à l'Institut européen de bioinformatique - affiché ici (domaine public) via Commons Wikimedia


